|
Vernacular Name
Cutín común de occidente
State/Provinces
El Oro, Esmeraldas, Guayas, Los Ríos, Manabí, Pichincha, Cañar, Azuay, Imbabura, Santo Domingo de los Tsáchilas, Cotopaxi, Santa Elena, Bolívar, Chimborazo, Carchi
Natural Regions
Matorral Seco de la Costa, Bosque Deciduo de la Costa, Bosque Húmedo Tropical del Chocó, Bosque Piemontano Occidental, Bosque Montano Occidental
Identification
Description
Color in Life
El patrón de coloración en esta especie es muy variable. El dorso puede variar de amarillo pálido, pasando por distintas tonalidades de naranja, gris y marrón hasta café oscuro; generalmente tiene un patrón de manchas en forma de V invertida (con un borde estrecho de color crema o verde-grisáceo en algunos individuos), algunos individuos presentan una línea media dorsal de color marrón claro a amarillo, usualmente con un delgado borde marrón o negro. Las marcas de la cabeza usualmente presentes en esta especie incluyen líneas cantales y post-orbitales marrones o negras y una línea labial pálida (blanca a crema-bronce). El vientre es blanco a blanco amarillento, tendiendo a convertirse en amarillo pálido posteriormente en algunos individuos. El pecho y garganta puede o no tener un moteado grisáceo. La superficie anterior de los muslos presenta líneas obscuras transversales y su superficie posterior tiene varios tonos de marrón con manchas o puntos de color crema, amarillo, naranja o rojo. El iris es amarillo pálido a bronce o dorado con manchas negras y una línea media horizontal roja. Lynch y Myers (7) presentan una descripción de los patrones encontrados desde Panamá a Ecuador encontrando dos morfotipos: el morfo berdery, el más común en Panamá, que se distingue por presentar bordes pálidos en las manchas obscuras del dorso y el morfo achatinus que carece de bordes claros en las manchas dorsales.
Males Face Cloacal Length Average
promedio = 28.7 mm (rango 23.0-35.1; n=46) (Especímenes de tierras bajas bajo los 700 m); promedio = 28.8 mm (rango 24.4-34.2; n=42) (Especímenes de Estribaciones del Pacífico, Balsapamba, Mindo, Tandapi) (2
Females Face Cloacal Length Average
promedio = 39.9 mm (rango 33.6-45.4; n=22) (Especímenes de tierras bajas bajo los 700 m); promedio = 42.1 mm (rango 37.0-46.1; n=33) (Especímenes de Estribaciones del Pacífico, Balsapamba, Mindo, Tandapi) (2
Habitat and Biology
Habita bosques secundarios y áreas abiertas artificiales como caminos, plantaciones agrícolas y potreros, no se ha encontrado en bosque primario. Es nocturna, aunque es posible encontrar juveniles activos en el día. Se la puede encontrar sobre la hojarasca o en vegetación baja. Es considerada como una especie colonizadora y de hábitos generalistas ( 4).
Reproduction
Los machos vocalizan en agrupaciones de hasta 5 individuos, desde el suelo o en vegetación arbustiva de hasta 2,5 metros y suelen cantar también durante el día. Se han encontrado hembras grávidas que contenían 29 y 42 huevos maduros. Los huevos son depositados en el suelo del bosque o en vegetación baja. Se reproduce por desarrollo directo, aparentemente durante todo el año (8).
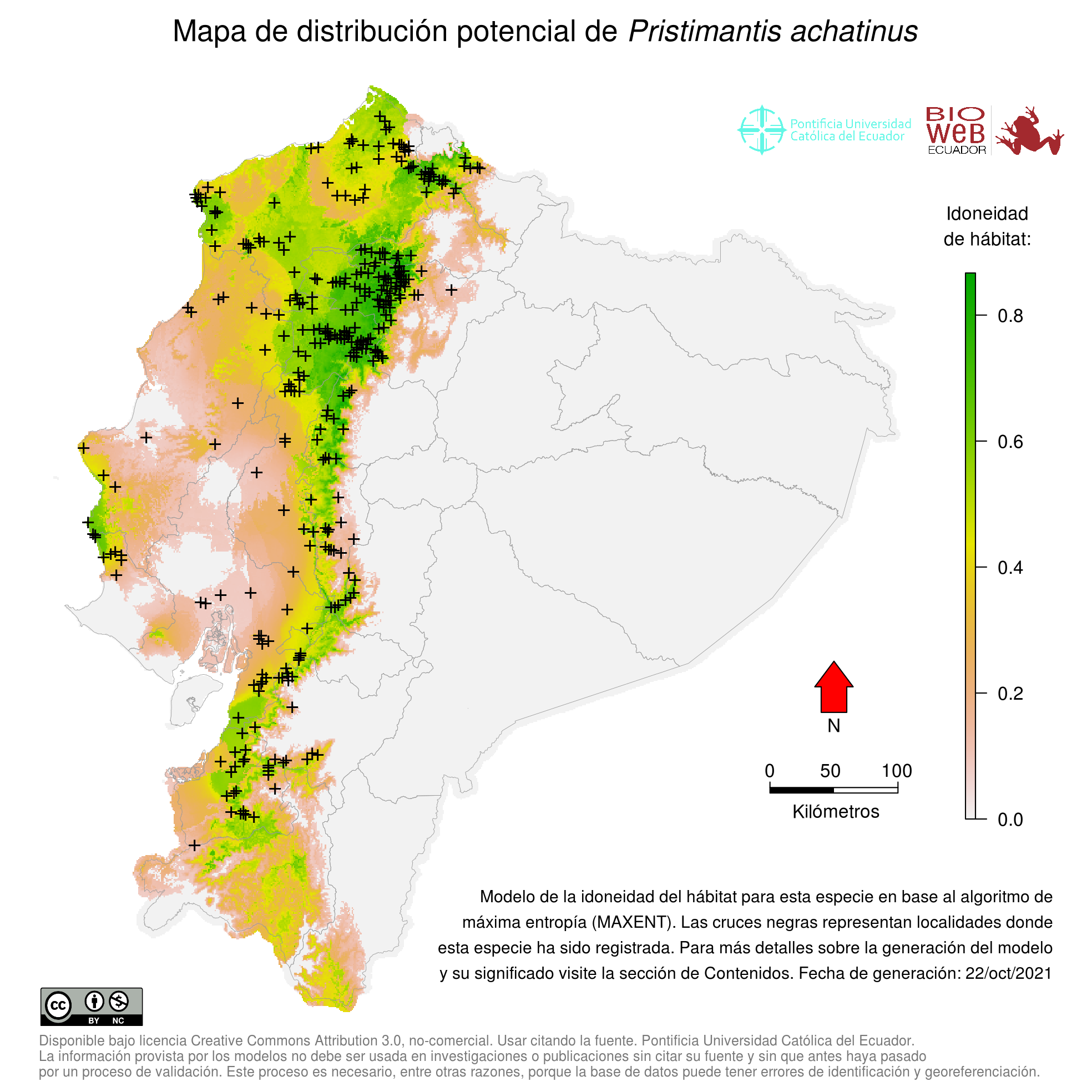
Distribution
En Ecuador, se conoce de muchas localidades de las tierras bajas de la costa y de las estribaciones occidentales de los Andes, de norte a sur (16).
Global Distribution
Altitudinal Range
De 0 a 2330 metros sobre el nivel del mar
Taxonomy and Evolutionary Relationships
Pristimantis achatinus es la especie hermana de Pristimantis lymani (9, 18). Dentro del grupo de especies Pristimantis conspicillatus (11, 12, 14).
Etymology
El epíteto específico podría derivarse del latín achates que significa ágata. Las palabras agathinus, achatinus y agatoide han sido usadas en historia natural y significan con apariencia de agata (10) y podría referirse a los patrones de coloración de la especie.
Additional Information
Lynch y Duellman (2) presentan las variaciones de coloración encontradas en diferentes localidades del oeste de Ecuador. Arteaga-Navarro et al. (17) presentan una breve descripción y un mapa de distribución de la especie.



Summary Author
Teresa Camacho-Badani, Nadia Páez-Rosales, Caty Frenkel, Andrea Varela-Jaramillo, Santiago R. Ron y Gabriela Pazmiño-Armijos
Editor
Teresa Camacho-Badani
Edition Date
2012-03-15T00:00:00
Update Date
2022-09-27T14:41:32.79
Literature Cited
Lynch, J. D. y Duellman, W. E. 1997. Frogs of the genus Eleutherodactylus in Western Ecuador: systematics, ecology, and biogeography. The University of Kansas, Natural History Museum, Special Publication 23:1-236.Enlace Boulenger, G. A. 1898. An account of the reptiles and batrachians collected by Mr. W. F. H. Rosenberg in western Ecuador. Proceedings of the Zoological Society of London:107-126, 9 pls. IUCN. 2018. The IUCN red list of threatened species. http://www.iucnredlist.org/search. (Consultado: 2018). Ruiz-Carranza, P.M., Lynch, J.D. y Ardila-Robayo, A.1996. Lista actualizada de la fauna de Amphibia de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 20:365-415. Ibáñez, R., Solís, F., Jaramillo, C. A. y Rand, S. 2000. An overwiew of the herpetology of Panama. In: Johnson, J.D., Webb, R.G. and Flores-Villela, O.A. (eds), Mesoamerican Herpetology: Systematics, Zoogeography and Conservation, pp. 159-170. . The University of Texas at El Paso. El Paso, Texas. Lynch, J. D. y Myers, C. W. 1983. Frogs of the fitzingeri group of Eleutherodactylus in eastern Panama and Chocoan South America (Leptodactylidae). Bulletin of the American Museum of Natural History: 481-572.Enlace MECN. 2010. Serie Herpetofauna del Ecuador: El Choco Esmeraldeño. Monografía. Museo Ecuatoriano de Ciencias Naturales. Quito-Ecuador 5:1-232. Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Brown, R. W. 1956. Composition of scientific words. Smithsonian Books, Washington, 882 pp. Pinto-Sánchez, N. R., Ibañez, R., Madriñan, S., Sanjur, O. I., Bermingham, E., Crawford, A. J. 2012. The great American biotic interchange in frogs: multiple and early colonization of Central America by the South American genus Pristimantis (Anura: Craugastoridae). Molecular Phylogenetics and Evolution 62:954-972. Padial, J. M., Grant, T., Frost, D. R. 2014. Molecular systematics of terraranas (Anura: Brachycephaloidea) with an assessment of the effects of alignment and optimality criteria. Zootaxa 3825:1-132. Duellman, W. E. y Lehr, E. 2009. Terrestrial breeding frogs (Strabomantidae) in Peru. NTV Science. Germany: 382 pp. Hedges, S. B., Duellman, W. E. y Heinicke, M. P. 2008. New World direct-developing frogs (Anura: Terrarana): Molecular phylogeny, classification, biogeography, and conservation. Zootaxa 1737:1-182. Ron, S. R., Guayasamin, J. M., Menéndez-Guerrero, P. 2011. Biodiversity and conservation status of ecuadorian amphibians. En: Heatwole, H., Barrio-Amoros C. L., Wilkinson, H. W. 2011. Amphibian Biology 9:129-170. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Arteaga, A. F., Bustamante, L. M., Guayasamin, J. M. 2013. The Amphibians and Reptiles of Mindo. Universidad Tecnológica Indoamérica, Quito, 258 pp. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|
