|
Vernacular Name
Rana de hojarasca boliviana
State/Provinces
Orellana, Sucumbíos
Natural Regions
Bosque Húmedo Tropical Amazónico
Identification
Es una rana mediana de color café claro, flancos y superficies anteriores de las extremidades oscuras y vientre blanco con manchas negruzcas. Presentan discos pequeños en los dedos. En la Amazonía de Ecuador, la especie más similar es Ctenophryne geayi debido a la coloración dorsal pálida fuertemente delineada por flancos obscuros. Se diferencian en que Ctenophryne geayi es más grande (LRC hembras > 42 mm), la coloración pálida del dorso es continua con la superficie dorsal de los brazos (coloración pálida del dorso separada del brazo por los flancos obscuros en Hamptophryne boliviana) y las superficies ventrales son totalmente obscuras con manchas blancas (garganta gris y vientre blanco con pequeñas manchas cafés negruzcas en Hamptophryne boliviana) (4, 5). La coloración de garganta y vientre en Hamptophryne boliviana es similar a Chiasmocleis bassleri, de la cual difiere por tener un dorso distinto de los flancos (dorso no diferenciado de flancos en Chiasmocleis bassleri (5). Otros microhílidos en la región como Chiasmocleis anatipes y Chiasmocleis ventrimaculata tienen la garganta y vientre blancos con grandes manchas negras e irregulares (garganta gris y vientre blanco con pequeñas manchas cafés negruzcas en Hamptophryne boliviana) (5). Chiasmocleis antenori (cuatro dedos en el pie) y Chiasmocleis tridactyla (tres dedos en el pie) posee un tímpano visible (tímpano oculto y cinco dedos en el pie en Hamptophryne boliviana) (5).
Description
Especie de tamaño mediano y cuerpo moderadamente robusto con la siguiente combinación de caracteres (modificado de Rodríguez y Duellman ( 4), Duellman ( 5)): (1) en vista dorsal, hocico punteagudo, el mismo que se va estrechando desde los ojos hacia la parte media para terminar en la punta que es truncada; (2) piel lisa dorsal y ventralmente; (3) extremidades moderadamente robustas; (4) dedos de manos y pies presentan discos terminales distintos y carecen de rebordes cutáneos y de membrana; (5) machos en reproducción carecen de excrescencias nupciales.
Color in Life
Dorso pálido, café claro o café grisáceo; una gran mancha mediadorsal e irregular café obscura generalmente está presente, así como una delgada línea mediadorsal blanco cremosa; flancos, lado de la cabeza y superficie anterior y posterior de muslos cafés obscuros; la coloración obscura de estas superficies contrasta fuertemente y delinea la coloración pálida del dorso; coloración del dorso no es continua sobre los brazos que también son pálidos, y se encuentran separados por los flancos obscuros; garganta café obscura con pequeñas manchas blanco cremosas; vientre y superficie ventral de extremidades posteriores blanco cremosas con pequeñas manchas irregulares o reticulaciones cafés negruzcas; iris bronce pálido con finas reticulaciones negras (4, 5).
Males Face Cloacal Length Average
promedio = 32.0 mm (n = 51) (19); (máximo 39; 4
Females Face Cloacal Length Average
promedio = 35.1 mm (rango = 32.2–37.7; n=15) (19
Habitat and Biology
Especie terrestre y nocturna que se encuentra mayormente en bosque primario y menos frecuentemente en bosque secundario y borde de bosque (4, 5, 19). Hamptophryne boliviana fue la especie de microhílido más abundante a lo largo del año en la Amazonía de Ecuador (5) y Perú (19, 32). Generalmente, la especie se encuentra en el piso del bosque y perchando en vegetación baja; sin embargo, la mayoría de individuos han sido encontrados en época lluviosa alrededor de pozas superficiales temporales y permanentes, e inclusive en la cercanía de riachuelos (5, 7, 9, 19, 24). La especie presenta reproducción explosiva (19), donde los machos se congregan alrededor de las pozas superficiales y cantan continuamente, generalmente después de fuertes lluvias (4, 5). Se han encontrado coros de más de 50 machos cantando sincronizadamente (9). Los machos cantan mientras flotan en el agua y el canto consiste en pitido corto “beep” (17), lo que difiere a lo reportado por Duellman (5) y Rodríguez y Duellman (4), quienes indican que el canto consiste en un “baaaah” largo y grave. Aichinger (19) reportó que en hembras grávidas se contaron en promedio 1486.5 (rango 855–2060) huevos ováricos maduros. Según Toft y Duellman (7), la especie presenta el Modo reproductivo 1 de Crump (1974), con huevos y renacuajos en agua léntica. La puesta de huevos consiste en una película depositada en la superficie del agua de las pozas (19), y contiene entre 182–280 huevos pigmentados, de 1.5 mm de diámetro (4). Los renacuajos alcanzan una longitud de 30 mm, de lo que el 65% corresponde a la cola (4), y viven cerca del fondo de pozas pequeñas y en cavidades llenas de agua dentro del bosque (23), aunque en el día han sido encontrados nadando individualmente cerca de la superficie (5).
En los estómagos de 25 individuos adultos de Hamptophryne boliviana se encontró principalmente hormigas (Hymenoptera), y menos frecuentemente termitas (Isóptera), tijeretas (Dermáptera), larvas y adultos de escarabajos pequeños (Coleóptera) (5), y ácaros (18). La especie ha sido observada alimentándose por la noche de columnas de hormigas sobre el suelo o sobre troncos y ramas de árboles hasta 1.5 m sobre el suelo (4, 5). Por otro lado, Hamptophryne boliviana fue parte de la dieta de la tarántula Ancylometes sp. (12), y fue el item terrestre más frecuente en la dieta del sapo bocón cornudo (Ceratophrys cornuta) en el Cuzco amazónico, Perú (6). Miller (25) reportó que Hamptophryne boliviana es capaz de comunicarse con la tarántula Xenesthis immanis, sugiriendo una relación de comensalismo. Este tipo de asociaciones entre microhílidos y tarántulas parecen ser comunes y podrían responder a su evolución en un medio ambiente terrestre y fosorial. Se ha reportado relaciones de aparente mutualismo entre Chiasmocleis ventrimaculata y tarántulas en Perú, Sudamérica (4), y entre el microhílido Ramanella nagaoi y tarántulas del género Poecilotheria en Sri Lanka, Asia (26). Al parecer, las ranas se alimentan de los depredadores de los huevos de las tarántulas, y viceversa. Los renacuajos de Hamptophryne boliviana han sido encontrados sintópicamente (en las mismas pozas) con renacuajos de Chiasmocleis anatipes y Chiasmocleis ventrimaculata; y adicionalmente, individuos adultos de estas tres especies han sido encontrados en la misma noche en el suelo cerca de las pozas (1). En la Amazonía ecuatoriana, Hamptophryne boliviana generalmente es simpátrica con los microhílidos Chaismocleis anatipes, Chiasmocleis ventrimaculata, Ctenophryne geayi, Synapturanus rabus, Syncope bassleri, Syncope tridactyla y Syncope antenori.
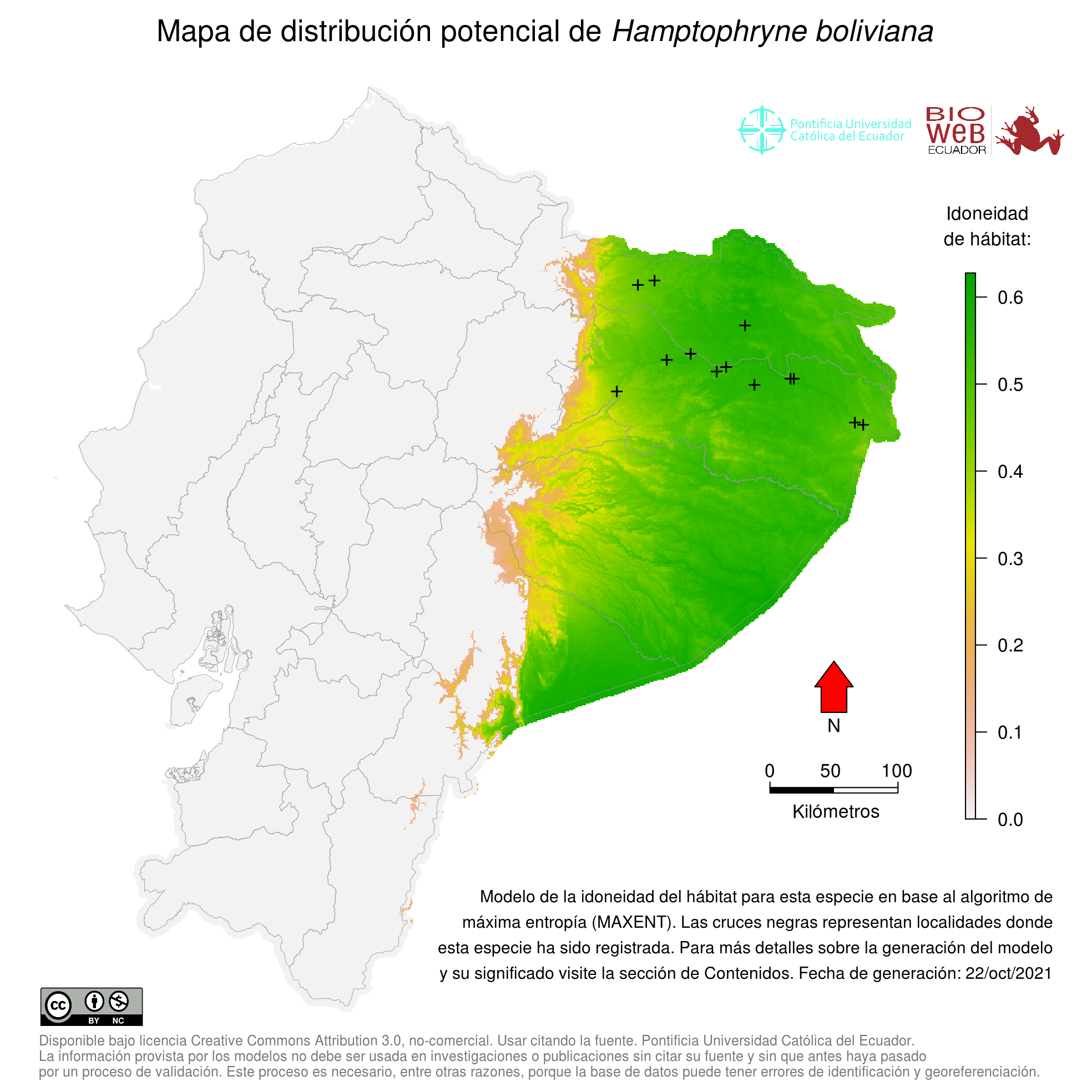
Distribution
Se distribuye en el norte y occidente de la Cuenca del Amazonas en Guyana, Guayana Francesa, Surinam, Venezuela (Estado de Bolívar), Brasil, Colombia, Ecuador, Perú y Bolivia (15).
Altitudinal Range
De 0 a 400 m sobre el nivel del mar (15).
Taxonomy and Evolutionary Relationships
Está cercanamente relacionado a Hamptophryne alios y Dermatonotus muelleri ( 14, 29, 30, 31). Fouquet et al. ( 11) encontraron una alta divergencia genética (> 3%) entre poblaciones de Hamptophryne boliviana de Guayana Francesa y Perú, sugiriendo la existencia de especies crípticas dentro de este taxón. En la filogenia de Jetz y Pyron ( 33) Hamptophryne boliviana está cercanamente relacionada a Arcovomer passarellii y Dermatonotus muelleri.
Additional Information
Nelson (17) y De la Riva et al. (28) describen el canto y presentan oscilogramas y audioespectrogramas. Bogart y Nelson (27) presentan una fotografía en vista dorso-lateral de un individuo y describen e ilustran el cariotipo (2N = 22 cromosomas). Duellman (5) describe el renacuajo y presenta una fotografía en vista dorso-lateral de un adulto de Santa Cecilia, Ecuador. Satel y Wassersug (22) estudiaron la anatomía de la cavidad oral del renacuajo y la relacionan con su modo de vida y tipo de alimentación. Zweifel (21) presenta ilustraciones de la cabeza de adultos en vista dorsal, y de la cintura pectoral y región palatal en vista ventral. De Sá y Trueb (23) describen el esqueleto de adultos, así como el desarrollo del condrocráneo y esqueleto de renacuajos. Carr y Altig (20) describen la configuración del músculo rectus abdominis del renacuajo (incluyendo una fotografía del músculo). Rodríguez y Duellman (4) describen brevemente el renacuajo y presentan una fotografía en vista dorso-lateral de un adulto de Iquitos, Perú. Lescure y Marty (10) proveen una fotografía y un relato de Guayana Francesa. Valencia et al. (2009) la incluyen en su guía de campo. Ouboter y Jairam (16) proveen un relato de Surinam.



Summary Author
Diego A. Ortiz
Editor
Edition Date
2013-11-27T00:00:00
Update Date
2022-09-26T21:01:11.183
Literature Cited
Walker, C. F. y Duellman, W. E. 1974. Description of a new species of microhylid frog, Chiasmocleis, from Ecuador. Occasional Papers of the Museum of Natural History, The University of Kansas, Lawrence, Kansas 26:1-6.PDF Parker, H. W. 1927. The brevicipitid frogs allied to the genus Gastrophryne. Occasional Papers of the Museum of Zoology, University of Michigan 187:40330.PDF Valencia, J., Toral, E., Morales, M., Betancourt, R. y Barahona, A. 2009. Guía de campo de anfibios del Ecuador. Fundación Herpetológica Gustavo Orcés, Simbioe. Maxigraf S. A., Quito 208. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Duellman, W. E. y Lizana, M. 1994. Biology of a sit-and-wait predator, the leptodactylid frog Ceratophrys cornuta. Herpetologica 50:51-64. Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Crump, M. 1974. Reproductive strategies in a tropical anuran community. Miscellaneous Publications of the Museum of Natural History. University of Kansas 61:1-68.PDF Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Fouquet, A., Gilles, A., Vences, M., Marty, C., Blanc, M., Gemmel, N. J. 2007. Underestimation of species richness in neotropical frogs revealed by mtDNA analyses. PLoS one 2:1-10. doi:10.1371/journal.pone.0001109PDF Menin, M., Rodrigues, J., de Azevedo, C. S. 2005. Predation on amphibians by spiders (Arachnida, Araneae) in the Neotropical region. Phyllomedusa 41:39-47. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Frost, D. R. 2013. Amphibian Species of the World: an online reference. Version 5.6 (15 October, 2012). Base de datos accesible en http://research.amnh.org/vz/herpetology/amphibia/ American Museum of Natural History, New York, USA. Ouboter, P. E. y Jairam, R. 2012. Amphibians of Suriname. Brill. 388 pp. Nelson, C. E. 1973. Mating calls of the Microhylinae: descriptions and phylogenetic and ecological considerations. Herpetologica 29:163-176.PDF Simon, M. P. y Toft, C. A. 1991. Diet specialization in small vertebrates: Mite-eating in frogs. Oikos 61:263-278. Aichinger, M. 1992. Fecundity and breeding sites of an anuran community in a seasonal tropical environment. Studies on Neotropical Fauna and Environment 27:9-18. Carr, K. M. y Altig, R. 1992. Configurations of the rectus abdominis muscle of anuran tadpoles. Journal of Morphology 214:351-356. Zweifel, R. G. 1986. A new genus an species of microhylid frog from the Cerro de la Neblina region of Venezuela and a discussion of relationships among new world microhylid genera. American Museum Novitates 2863:1-24. Satel, S. L. y Wassersug, R. J. 1981. On the relative sizes of buccal floor depressor and elevator musculature in tadpoles. Copeia 1981:129-137. De Sá, R. O. y Trueb, L. 1991. Osteology, skeletal development, and chondrocranial structure of Hamptophryne boliviana (Anura: Microhylidae). Journal of Morphology 209:311-330. Bernarde, P. S. y Macedo, L. C. 2008. Impacto do desmatamento e formação de pastagens sobre a anurofauna de serapilheira em Rondônia. Iheringia 98:454-459. Miller, G. 2003. Observations of commensalism between burrowing theraphosid spiders and the microhylid frog species, Hamptophrynes boliviana. CNR Student Research Symposium, College of Natural Resources, University of Wisconsin - Stevens Point: 24. Karunarathna, D. M. S. S. y Amarasinghe, A. A. T. 2009. Mutualism in Ramanella nagaoi Manamendra-Arachchi & Pethiyagoda, 2001 (Amphibia: Microhylidae) and Poecilotheria species (Aracnida: Thereposidae) from Sri Lanka. Taprobanica 1:16-18. Bogart, J. P. y Nelson, C. E. 1976. Evolutionary implications from karyotypic analysis of frogs of the families Microhylidae and Rhinophrynidae. Herpetologica 32:199-208. De la Riva, I., Márquez, R., Bosch, J. 1996. Advertisement calls of four microhylid frogs from Bolivia (Amphibia, Anura). American Midland Naturalist 136:418-422. De Sá, R. O., Streicher, J. W., Sekonyela, R., Forlani, M. C., Loader, S. P., Greenbaum, E., Richards, S., Haddad, C. F. B. 2012. Molecular phylogeny of microhylid frogs (Anura: Microhylidae) with emphasis on relationships among New World genera. BMC Evolutionary Biology 12:1-21.PDF Peloso, P. L. V., Sturaro, M. J., Forlani, M. C., Gaucher, P., Motta, A. P., Wheeler, W. C. 2014. Phylogeny, taxonomic revision, and character evolution of the genera Chiasmocleis and Syncope (Anura: Microhylidae) in Amazonia, with descriptions of three new species. Bulletin of the American Museum of Natural History 386:1-112. Pyron, R. A. 2014. Biogeographic analysis reveals ancient continental vicariance and recent oceanic dispersal in amphibians. Systematic Biology 63:779-797. Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|





 Map of Life
Map of Life



