|
Vernacular Name
Rana nodriza de Machalilla
State/Provinces
Bolívar, El Oro, Guayas, Los Ríos, Manabí, Pichincha, Cañar, Santa Elena, Cotopaxi
Natural Regions
Matorral Seco de la Costa, Bosque Deciduo de la Costa, Bosque Húmedo Tropical del Chocó, Bosque Piemontano Occidental
Identification
Es una rana muy pequeña de coloración dorsal canela-oliva con marcas en forma de "X" en la región escapular de color café oscuro, presenta una raya lateral oblicua que se extiende desde el ojo, el abdomen es color crema, marcas difusas de color naranja en axila e ingle, disco del Dedo manual III ligeramente expandido y disco del Dedo pedial IV expandido, Dedo manual I usualmente más largo que el II, Dedo manual III hinchado en machos y testículos de color café. Es similar a Hyloxalus breviquartus, Hyloxalus cevallosi y Leucostethus fugax por tener una línea lateral oblicua completa y vientre inmaculado, además de membranas rudimentarias o ausentes entre los dedos de los pies. Se distingue de Hyloxalus breviquartus e Hyloxalus cevallosi ya que los machos presentan el Dedo manual III hinchado. Difiere de Leucostethus fugax en que es ligeramente más grande y usualmente tiene una marca en forma de "X" en la región escapular. Epipedobates machalilla se asemeja también a Hyloxalus toachi en que tiene los testículos cafés y vientre inmaculado en hembras; sin embargo los machos de Hyloxalus toachi tienen un rubor negro en la región gular; las hembras se distinguen por el patrón dorsal (marca en forma de "X" en Epipedobates machalilla) (1).
Description
Es una rana de tamaño muy pequeño con la siguiente combinación de caracteres (modificado de Coloma (1)): (1) piel del dorso del cuerpo, extremidades, flancos y vientre lisa; línea oblicua lateral presente, extendiéndose hasta el ojo; línea dorsolateral ausente; línea ventrolateral presente; (2) hocico redondeado en vista dorsal y protuberante en vista lateral; (3) región loreal ligeramente cóncava; fosas nasales ligeramente protuberantes en vista lateral; (4) pliegue supratimpánico difuso, obscureciendo la parte posterodorsal del tímpano que apenas visible; (5) brazos moderadamente largos; Dedo manual I ligeramente más largo que el II; Dedo manual III hinchado en machos; dedos de la mano sin membrana ni rebordes cutáneos; discos ligeramente expandidos; (6) tubérculos subarticulares grandes, elevados y redondos; tubérculo palmar grande, redondo poco elevado; tubérculo tenar moderadamente redondo, más pequeño que el palmar; (7) extremidades posteriores moderadamente robustas y largas; dedos pediales sin rebordes cutáneos; discos ligeramente expandidos; fórmula de la membrana entre los dedos pediales: I 2–3½ II 2–3½ III 3–4 IV 4½–3 V; (8) pliegue tarsal externo ausente; (9) tubérculos subarticulares pequeños y redondos; tubérculos supernumerarios ausentes.
Color in Life
Dorso de color canela-oliva con marcas en forma de "X" en la región escapular de color café oscuro. Vientre crema.
Canthus y flancos de café oscuro a negro. Superficie posterior del muslo con franjas naranja amarillentas justo debajo del nivel de la cloaca. Marcas difusas de color naranja en axila e ingle. Superficie dorsal de las patas de color café pálido con leves franjas estrechas de color café oscuro. Brazos naranja pálidos labio superior crema con tonos rosáceos. Raya lateral oblicua de color crema. Iris dorado. Testículos de color café (1).
Males Face Cloacal Length Average
rango = 14.4–16.0 mm; n=22 (1
Females Face Cloacal Length Average
promedio = 15.8 mm (rango 15.0–17.6 mm; n=28) (1
Habitat and Biology
Especie diurna y terrestre, asociada a hojarasca, piedras y lodo de riveras de ríos permanentes, esteros, cascadas y quebradas. Pueden vivir en hábitats disturbados como plantaciones de cacao y banano. Vive en simpatría con Hyloxalus awa en las Montañas de Chindul en la Cordillera de la Costa y con Hyloxalus infraguttatus a 600 m en la cuenca de Río Chimbo y en la Cordillera de la Costa (1, 13, 15).
Reproduction
El cortejo es elaborado e incluye amplexus cefálico. Las puestas terrestres (en la hojarasca o sobre plantas, en terrarios) consisten de 15 huevos (rango 8–21; n = 72) y los huevos tienen 1.6 mm de diámetro. El cuidado parental lo lleva a cabo el macho, quien también transporta las larvas. El desarrollo desde la fertilización hasta que los renacuajos eclosionan para ser transportados toma entre 19–20 días. Los renacuajos son cargados por el macho a pequeñas pozas en las orillas de los riachuelos (1, 13, 15).
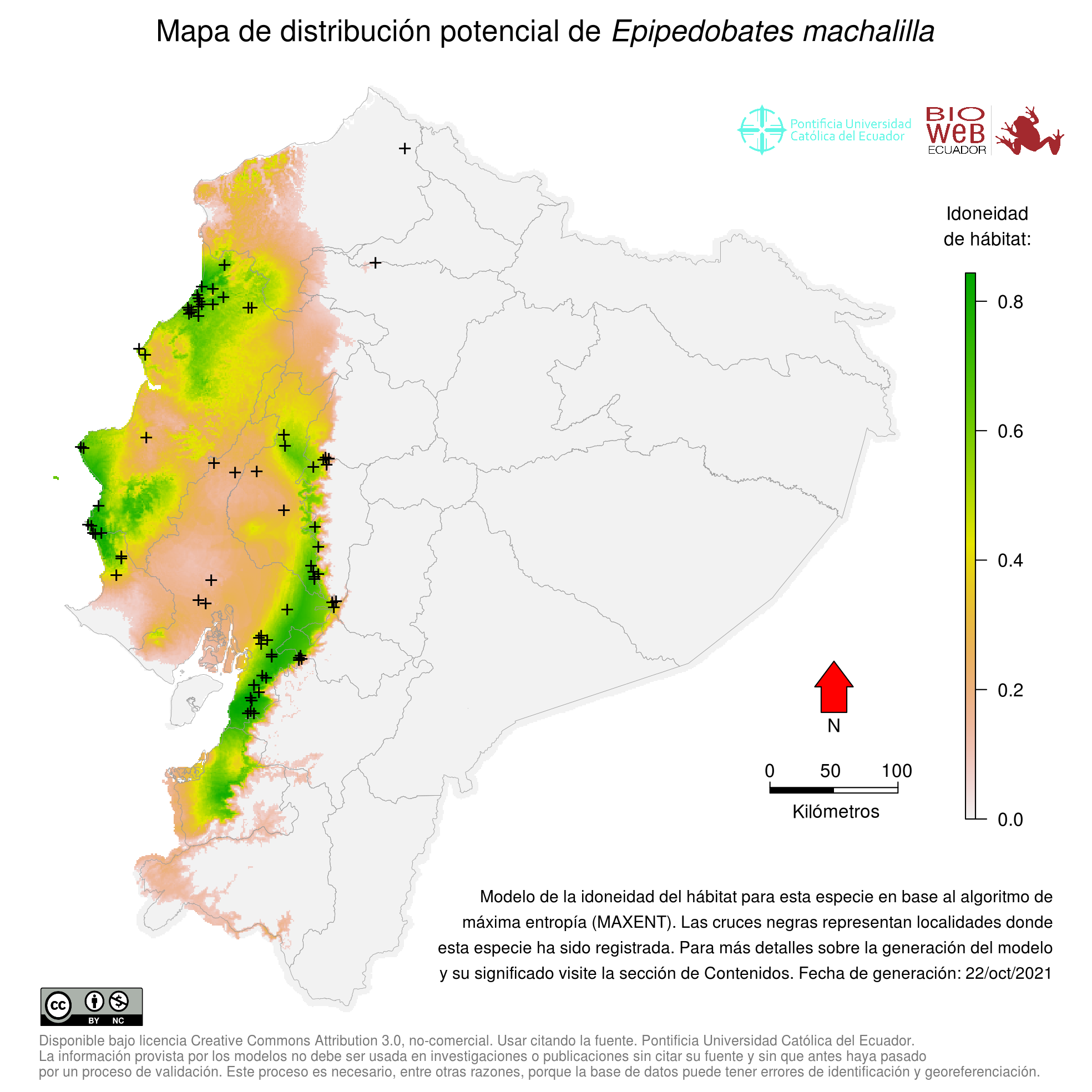
Distribution
Es una especie endémica de los Bosques Tropicales Noroccidentales del Pacífico del Ecuador (14).
Altitudinal Range
Se encuentra desde los 10 a los 515 m sobre el nivel del mar.
Taxonomy and Evolutionary Relationships
Originalmente descrita bajo el género Colostethus (1); posteriormente fue ubicada dentro del género Hyloxalus en base a una revisión detallada de la familia Dendrobatidae (4). Las filogenias publicadas hasta la fecha no llegan a un consenso sobre su ubicación evolutiva y carecen de un soporte robusto, pero claramente muestran una relación cercana con Epipedobates anthonyi y Epipedobates tricolor. Su especie hermana hipotética es Epipedobates anthonyi (8), Epipedobates tricolor (3), ó Epipedobates anthonyi y Epipedobates tricolor (2, 4, 15, 17).
Etymology
El nombre del género proviene del griego epipedos que significa "sobre el suelo" y bates que significa "corredor", y hace referencia a la naturaleza primordialmente terrestre de la mayoría de especies (6, 12). El epíteto específico hace referencia al Parque Nacional Machalilla, lugar donde se encuentra esta especie (1).
Additional Information
Parker y Carr (7) reportan su presencia (como Colostethus sp. 1) en el Parque Nacional Machalilla. Coloma (1) describe la especie e incluye datos de morfología, renacuajos, distribución, ecología. Además provee una ilustración en blanco y negro del dorso de un adulto y de un renacuajo en vista lateral. Benitez y del Pino (9) proveen datos sobre la expresión de Brachyury durante el desarrollo. Del Pino et al. (10) proveen datos sobre la expresión diferencial en células somáticas y germinales de LAP-2 (un polipéptido asociado a la lámina), el cual estaría implicado en la gastrulación durante el desarrollo temprano. Santos et al. (2, 3) y Grant et al. (4) proveen información molecular y filogenética y discuten aspectos de evolución. Del Pino et al. (13) proveen datos del desarrollo embriónico y analizan su morfología. A pesar de que Epipedobates machalilla no forma un disco embriónico, los labios gruesos de su blastoporo se parecen al disco embriónico de la rana marsupial Gastrotheca riobambae (13). Graham et al. (8) proveen datos de distribución, ambiente geográfico y nichos ambientales, los cuales son utilizados para explorar mecanismos de especiación. Pérez et al. (11) proveen datos del ortólogo del factor de transcripción VegT, el cual es un determinante meso-endodérmico en Xenopus laevis. Este ortólogo comparte con otras especies de anuros un dominio conservado de 57 aminoácidos en el terminal-C. Moya et al. (5) proveen datos y comparan con otras especies de ranas la formación del blastoporo, disco embriónico, elongación del arquenterón y notocordio y expresión de Brachyury. Las diferencias reportadas indican que la gastrulación de los anfibios es modular. Lötters et al. (6) proveen un sumario de la especie con datos de distribución, hábitat natural, morfología y biología. Además presentan fotografías a color en vista dorso-lateral de cuatro individuos de Ecuador (Provincia del Guayas).



Summary Author
Luis A. Coloma, Caty Frenkel, Diego A. Ortiz y Gabriela Pazmiño-Armijos
Editor
Luis A. Coloma y Santiago R. Ron
Edition Date
2010-06-17T00:00:00
Update Date
2022-12-16T14:15:41.703
Literature Cited
Coloma, L. A. 1995. Ecuadorian frogs of the genus Colostethus (Anura: Dendrobatidae). Miscellaneous Publications of the Museum of Natural History, University of Kansas 87:1-72.PDF Santos, J. C., Coloma, L. A. y Cannatella, D. C. 2003. Multiple, recurring origins of aposematism and diet specialization in poison frogs. Proceedings of the National Academy of Sciences 100:12792-12797. Santos, J. C., Coloma, L.A., Summers, K., Caldwell, J. P., Ree, R., Cannatella, D. C. 2009. Amazonian amphibian diversity is primarily derived from late miocene andean lineages. PLoS Biol 7:3100005610.1371.1000056.PDF Grant, T., Frost, D. R., Caldwell, J. P., Gagliardo, R. W., Haddad, C. F. B., Kok, P., Means, D. B., Noonan, B. P., Schargel, E., Wheeler, W. C. 2006. Phylogenetic systematics of dart-poison frogs and their relatives (Amphibia: Athesphatanura, Dendrobatidae). Bulletin of the American Museum of Natural History 299:262.PDF Moya, I. M., Alarcón, I., del Pino, E. 2007. Gastrulation of Gastrotheca riobambae in comparison with other frogs. Developmental Biology 304: 467–478.PDF Lötters, S., Jungfer, K., Henkel, F. W. y Schmidt, W. 2007. Poison frogs. Biology, species and captive husbandry. Edition Chimaira, Frankfurt am Main, Germany, 668 pp. Parker III, T. A. y Carr, J. L (eds.). 1992. Status of forest remnants in the Cordillera de la Costa and adjacent areas of southwestern Ecuador. RAP. Working Papers. 2:1-172. Conservation International. Washington, D.C. Graham, C. H., Ron, S. R., Santos, J. C., Schneider, C. J., Moritz, C. 2004. Integrating phylogenetics and environmental niche models to explore speciation mechanisms in dendrobatid frogs. Evolution 58:1781-1793.PDF Benitez, M. S. y del Pino, E. 2002. Expression of Brachyury during development of the dendrobatid frog Colostethus machalilla. Developmental Dynamics 225: 592–596.PDF del Pino, E., Sáenz, F. E., Pérez, O., Brown, F. D., Ávila, M. E., Barragán, A., Haddad, N., Paulin-Levasseur, M. 2002. Lamina-associated polypeptide 2 (lap2) expression in fish and amphibians. International Journal of Developmental Biology 46: 227–234.PDF Pérez, O., Benitez, M. S., Nath, K., Heasman, J. y del Pino, E. 2006. Comparative analysis of Xenopus VegT, the meso-endodermal determinant, identifies an unusual conserved sequence. Differentiation, doi: 10.1111/j.1432-0436.2007.00172.x. Myers, C. W. 1987. New generic names for some neotropical poison frogs (Dendrobatidae). Papeis Avulsos do Zoologia. Mus. Zool. Univ. Sao Paulo 36:301-306. del Pino, E., Ávila, M. E., Pérez, O., Benitez, M. S., Alarcón, I., Noboa, V. y Moya, I. M. 2004. Development of the dendrobatid frog Colostethus machalilla. International Journal of Developmental Biology 48: 663–670.PDF MECN. 2010. Serie Herpetofauna del Ecuador: El Choco Esmeraldeño. Monografía. Museo Ecuatoriano de Ciencias Naturales. Quito-Ecuador 5:1-232. Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|
