|
Vernacular Name
Rana de cristal de Chiriqui
State/Provinces
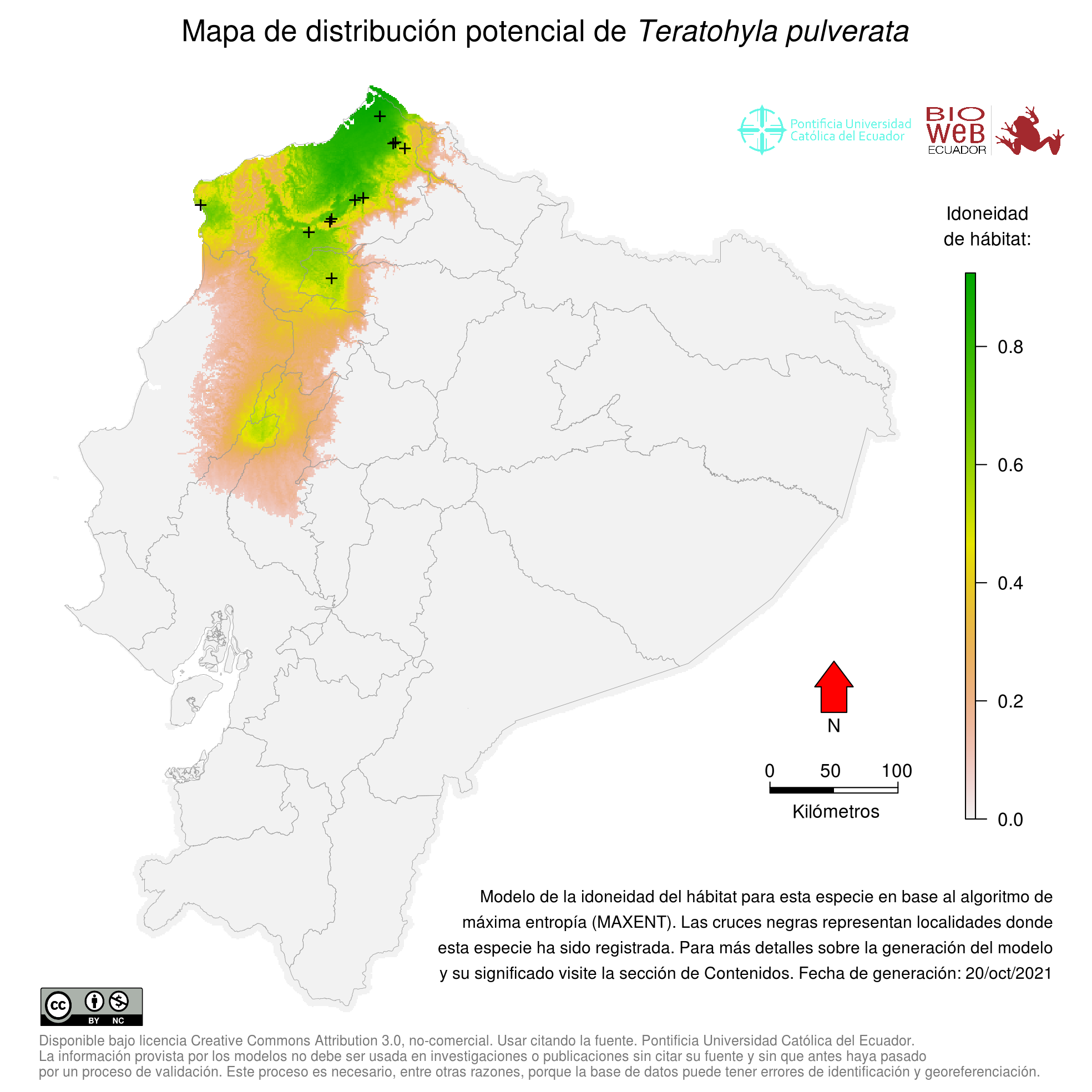
Pichincha, Esmeraldas
Natural Regions
Bosque Húmedo Tropical del Chocó, Bosque Piemontano Occidental
Identification
Es una rana pequeña con coloración dorsal verde con pequeños puntos blancos, peritoneo parietal ventral completamente transparente, peritoneo gastrointestinal y hepático blancos, hocico inclinado visto de perfil, carece de espinas humerales. Solo las especies de Hyalinobatrachium podrían confundirse con Teratohyla pulverata; sin embargo, Teratohyla pulverata tiene huesos verdes (blancos en Hyalinobatrachium) y dientes conspicuos en los vómeros (dientes ausentes en Hyalinobatrachium). Cochranella mache se distingue por tener tubérculos amarillos en un dorso verde azulado. Además, Cochranella mache tiene pliegue dérmico en los bordes externos del antebrazo y tarso (pliegues ausentes en Teratohyla pulverata; 15).
Description
Es una rana de tamaño pequeño con la siguiente combinación de caracteres (modificado de Bustamante et al. (1) y Kubicki (11)): (1) proceso dentígero del vómero con 2-4 dientes; (2) hocico redondeado visto dorsalmente, inclinado visto lateralmente; (3) tímpano visible, relativamente pequeño, diámetro 20.2-23.3% del diámetro del ojo; anillo timpánico visible excepto por el borde dorsal cubierto por pliegue supratimpánico; membrana timpánica diferenciada y translúcida, pigmentada como la piel a su alrededor; (4) dorso levemente granular; machos con pequeñas espículas visibles bajo magnificación; (5) superficie ventral granular, superficie posterior ventral de los muslos sin un par de tubérculos agrandados; (6) peritoneo parietal ventral completamente transparente; pericardio y peritoneo gastrointestinal blancos; (7) hígado bulboso cubierto por peritoneo blanco; (8) espinas humerales ausentes; (9) membrana entre los dedos I y II de la mano ausente o basal; fórmula de membranas de la mano para los dedos externos: II (1+-1⅓) — (2⅘-3-) III (1⅓-1⅔) — (1+-2-) IV; (10) pies con membranas hasta dos terceras partes de la longitud de los dedos; fórmula de membrana de los pies: I (1-1) — (1⅔-2-) II (1-1) — (1¾-2-) III (1-1+) — (1⅔-2+) IV (2-2+) — (1-1+) V; (11) pliegues metacarpal, ulnar, metatarsal y tarsal esmaltados, con pequeños tubérculos que les dan una forma ondulada; (12) almohadilla nupcial Tipo I; prepólex oculto; (13) Dedos de la mano I y II casi del mismo largo (DII/DI = 0.980-1.025); (14) disco del Dedo de la mano III pequeño, su ancho 20.1-23.5% del diámetro del ojo; (15) melanóforos cubren parcialmente la superficie dorsal del Dedo IV de la mano, ausente en los Dedos I-III.
Color in Life
Dorso verde con puntos blancos pequeños. Peritoneo parietal transparente, todos los órganos internos visibles internamente; peritoneo blanco cubriendo el hígado, tracto digestivo, testículos y vesícula biliar; peritoneo transparente cubriendo vejiga urinaria y riñones; el corazón puede estar cubierto o no por pericardio blanco. Dorsalmente, las extremidades tienen color verde con puntos amarillos pálidos, con blanco en el centro. Labio superior con una línea blanca delgada. Puntos blancos pequeños visibles bajo el ojo. Pliegue ulnar y tarsal con puntos blancos pequeños. Región cloacal con tubérculos blancos numerosos. Iris blanco grisáceo con finas reticulaciones gris oscuras; una fina línea amarilla bordea la pupila (descripción basada en fotografías a color de la especie) (2).
Males Face Cloacal Length Average
rango 22.0-24.5 mm; n = 13 (9
Females Face Cloacal Length Average
rango 25.3-28.3 mm; n = 5 (9
Habitat and Biology
Especie arborícola, nocturna asociada a riachuelos torrentosos en bosque primario y secundario. Las hembras depositan sus huevos en el haz de las hojas entre los 2 y 4 m sobre riachuelos, no existe cuido parental (11, 15). A diferencia de otras especies de centrolénidos, sus puestas de huevos tienen la superficie crenulada, los huevos son amarillo verdosos y son depositados en una sola capa (Hawley 2006). El color verde amarillento del huevo persiste al menos los cinco primeros días de desarrollo, luego cambia de rosado claro a oscuro en los siguientes cinco días y finalmente a sombras rojas oscuras durante el resto del desarrollo. El número de huevos por puesta varía de 23 a 57 (n = 62). La duración máxima del desarrollo desde la oviposición hasta la eclosión del último huevo fue 9 a 24 días (16.0 ± 0.4, n = 55), mientras la duración mínima fue 6 a 19 días (12.5 ± 0.4, n = 55). Hubo una correlación entre el número de puestas eclosionadas y la presencia de lluvia en la noche. La supervivencia por masa de huevos fue 85% ± 4% (n = 59); cerca de la mitad de las masas (42%) eclosionó sin mortalidad. La mortalidad causada por factores abióticos varió temporalmente. La desecación causó mortalidad en julio y agosto y las inundaciones produjeron mortalidad en septiembre. Los embriones en masas con alta mortalidad empezaron y terminaron de eclosionar antes que los embriones con baja mortalidad. Esta respuesta podría darse para evadir la mortalidad por infecciones de hongos en embriones muertos o relacionados con predación de embriones en la misma puesta. Los machos cantan desde el haz de las hojas, el canto es un “tik” rápido y de alta frecuencia, normalmente repetido varias veces con alrededor de un segundo de pausa entre cantos (1, 11). La frecuencia dominante es 5.7-6.2 kHz (7, 12). En Ecuador, Teratohyla pulverata ha sido encontrada en simpatría con Espadarana prosoblepon y Hyalinobatrachium tatayoi en el estero Aguacate y con Sachatamia ilex, Espadarana callistomma, Sachatamia albomaculata y Hyalinobatrachium aureoguttatum en el río Bogotá (1). Fórmula de fila de dientes en renacuajos 2/3; A2 fila de dientes ampliamente separada en el centro (14).
Distribution
Cuenca caribe del oriente de Honduras y Nicaragua y estribaciones pacíficas en las tierras bajas de Costa Rica y Panamá. También se conoce de los bosques de tierras bajas en la vertiente occidental de los Andes de Colombia (valle del Cauca) y Ecuador a elevaciones bajo los 800 m (1, 6, 8, 9, 10, 15, 21, 22).
Altitudinal Range
de 2 a 960 m sobre el nivel del mar
Taxonomy and Evolutionary Relationships
Está cercanamente relacionada a Teratohyla amelie ( 16). Dada la distribución en las tierras bajas de estas dos especies— Teratohyla amelie al este de los Andes y Teratohyla pulverata desde el oeste de los Andes—el mecanismo más probable de especiación es la vicarianza a través del levantamiento de los Andes ( 16). Guayasamin et al. ( 4) la asignaron al género Teratohyla. Previamente estuvo asignada a los géneros Hyla, Centrolenella, Cochranella e Hyalinobatrachium ( 5, 15). Guayasamin et al. ( 2) designan a Cochranella petersi ( 2) como sinónimo junior.
Etymology
El nombre Teratohyla se deriva del griego teras que significa "maravilla", y la palabra Hyla asociada tradicionalmente a las ranas arborícolas (4). El epíteto específico proviene del latín pulverus que significa "polvo", y del sufijo -atus que quiere decir "provisto de", refiriéndose a los puntos blancos dispersos en el dorso que caracteriza a esta especie en vida (9, 11).
Additional Information
Guayasamin et al. (2) presentan fotos en preservado y del holotipo. Bustamante et al. (1), Kubicki (11), Guayasamin et al. (4) presentan fotos en vida. García (20) describe su cariotipo y lo compara con los de Hyalinobatrachium aureoguttatum, Nymphargus grandisonae y Teratohyla spinosa.



Summary Author
Juan M. Guayasamin, Caty Frenkel, Andrea Varela-Jaramillo, Santiago R. Ron y Gabriela Pazmiño-Armijos
Editor
Juan M. Guayasamin y Santiago R. Ron
Edition Date
2016-11-07T00:00:00
Update Date
2022-09-21T21:29:23.787
Literature Cited
Bustamante, M. R., Cisneros-Heredia, D. F., Yánez-Muñoz, M. H., Ortega-Andrade, H. M., Guayasamin, J. M. 2007. Notes on geographic distribution: Amphibia, Centrolenidae, Cochranella pulverata, Hyalinobatrachium aureoguttatum: distribution extension, Ecuador. Check List 3:271-276.PDF Guayasamin, J. M., Cisneros-Heredia, D. F. y Castroviejo-Fisher, S. 2008. Taxonomic identity of Cochranella petersi Goin, 1961 and Centrolenella ametarsia Flores, 1987. Zootaxa 1815:25-34.PDF Peters, W. K. 1873. Über eine neue Schildkrotenart, Cinosternon Effeldtii und einige andere neue oder weniger bekannte Amphibien. Monatsberichte der Preussischen Akademie der Wissenschaften zu Berlin 1873:603-618.PDF Guayasamin, J. M., Castroviejo-Fisher, S., Trueb, L., Ayarzagüena, J., Rada, M., Vila, C. 2009. Phylogenetic systematics of glassfrogs (Amphibia: Centrolenidae) and their sister taxon Allophryne ruthveni. Zootaxa 2100:1-97.PDF Cisneros-Heredia, D. F. y McDiarmid, R. W. 2007. Revision of the characters of Centrolenidae (Amphibia: Anura, Athesphatanura), with comments on its taxonomy and the description of new taxa of glassfrogs. Zootaxa 1572:1-82.PDF Ruiz-Carranza, P.M., Lynch, J.D. y Ardila-Robayo, A.1996. Lista actualizada de la fauna de Amphibia de Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 20:365-415. Ibáñez, R., Rand, S. y Jaramillo, C. A. 1999. Los anfibios del Monumento Natural Barro Colorado, Parque Nacional Soberanía y áreas adyacentes. Mizrachi, E. and Pujol, S.A. Santa Fe de Bogota, 187. Savage, J. M. 2002. The amphibians and reptiles of Costa Rica: A herpetofauna between two continents, between two seas. University of Chicago Press, Chicago, USA, 934 pp. McCraine, J. R. y Wilson, L. D. 2002. The Amphibians of Honduras. Society for the Study of Amphibians and Reptiles. Ithaca, New York, USA. . Köhler, G. 2001. Anfibios y reptiles de Nicaragua. Herpeton. Offenbach, Germany. Kubicki, B. 2007. Ranas de vidrio Costa Rica/Glass frogs of Costa Rica. Instituto Nacional de Biodiversidad, INBio. Savage, J. A. y Starret, P. H. 1967. A new fringe-limbed tree-frog (family Centrolenidae) from lower Central America. Copeia 1967:604–609. Hawley, T. J. 2006. Embryonic development and mortality in Hyalinobatrachium pulveratum (Anura: Centrolenidae) of south-western Costa Rica.. Journal of Tropical Ecology, 22:731734. Hoffman, H. 2004. Description of the previously unknown tadpole of Hyalinobatrachium pulveratum (Anura: Centrolenidae). Revista de Biología Tropical, 52: 219228. MECN. 2010. Serie Herpetofauna del Ecuador: El Choco Esmeraldeño. Monografía. Museo Ecuatoriano de Ciencias Naturales. Quito-Ecuador 5:1-232. Guayasamin, J., Cisneros-Heredia, D., McDiarmid, R., Peña, P., Hutter, C. 2020. Glassfrogs of Ecuador: Diversity, Evolution, and Conservation. Diversity 12 222. Garcia, A. 2013. Análisis de los cromosomas mitóticos de cuatro especies de anuros de la familia Centrolenidae. Tesis de Licenciatura en Ciencias Biológicas. Pontificia Universidad Católica del Ecuador. Quito, Ecuador. Solís, F., Ibáñez, R., Grant, T., Acosta-Galvis, A. R., Kubicki, B. 2010. Teratohyla pulverata. The IUCN Red List of Threatened Species. e.T55030A11242870. http://dx.doi.org/10.2305/IUCN.UK.2010-2.RLTS.T55030A11242870.en. Acosta-Galvis, A. 2000. Ranas, Salamandras y Caecilias (Tetrapoda: Amphibia) de Colombia 1: 289-319-289-319. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/
|
