|
Vernacular Name
Rana de casco de Sarayacu
State/Provinces
Napo, Orellana, Pastaza, Sucumbíos, Morona Santiago
Natural Regions
Bosque Húmedo Tropical Amazónico
Identification
Es una rana mediana de color bronce, flancos con puntos blancos grandes y vientre blanco. Presenta una cabeza ancha, iris dorado con reticulaciones negras, borde del labio blanco y discos expandidos en los dedos. La ausencia de calcares en los talones la diferencian de Boana calcarata, Boana fasciata e Boana geographica. Se diferencia de Osteocephalus taurinus y Osteocephalus planiceps por ser más pequeña y tener un iris bronce con reticulaciones negras muy gruesas (iris dorado o bronce con líneas negras radiando de la pupila en Osteocephalus planiceps y Osteocephalus taurinus). La presencia de manchas blancas conspicuas en los flancos la diferencian de todas las especies de Osteocephalus de la Amazonía ecuatoriana.
Description
La siguiente descripción se basa en Duellman (6). La cabeza es ancha y plana. Las membranas están ausentes en las manos y en los pies sólo llegan a la mitad de los dedos. La piel dorsal es lisa, en el vientre es granular. El tímpano es grande.
Color in Life
El dorso es bronce, generalmente marcado con puntos irregulares pequeños de color marrón oscuro o negro; los puntos son más numerosos medio-dorsalmente en la mitad posterior del cuerpo. Manchas marrones oscuras están presentes en las superficies dorsales de las pantorrillas. Los flancos y las superficies anteriores y posteriores de los muslos son bronce cremoso. La garganta y el vientre son blancos con manchas rojizas pequeñas y las superficies ventrales de las extremidades son marrones. El borde del labio superior es crema. Los juveniles (< de 25 mm longitud rostro cloacal, LRC) tienen rayas dorsolaterales amplias color crema que se hacen más estrechas en la cabeza y más anchas en la región escapular. En la cabeza las rayas están limitadas externamente por líneas cantales y supratimpánicas de color marrón oscuro. En especímenes de 25 a 30 mm de LRC, las rayas dorsolaterales y las rayas oscuras son difusas y en la mayoría de los especímenes de más de 30 milímetros, no hay evidencia de rayas. El iris es dorado verdoso con reticulaciones negras. Los machos en reproducción tienen excrecencias nupciales queratinizadas cafés en los pulgares (6).
Males Face Cloacal Length Average
34 mm. (6
Females Face Cloacal Length Average
Promedio = 41.4 mm (rango 35–46, n = 21). (6
Habitat and Biology
Duellman (6) encontró esta especie en una gran variedad de hábitats incluyendo áreas abiertas, plantaciones de plátano, pantanos, y bosque primario, con la mayoría de los individuos en bosque secundario. Encontraron los juveniles y los subadultos durante el día envueltos en hojas de Heliconia. Esta especie era abundante en Santa Cecilia, sin embargo ningún comportamiento de reproducción, cantos, o renacuajos fueron observados. Las hembras tenían huevos ováricos maduros todos los meses excepto diciembre. En base al número y tamaño de los huevos ováricos Duellman (6) asumió que la especie se reproduce en agua estancada.
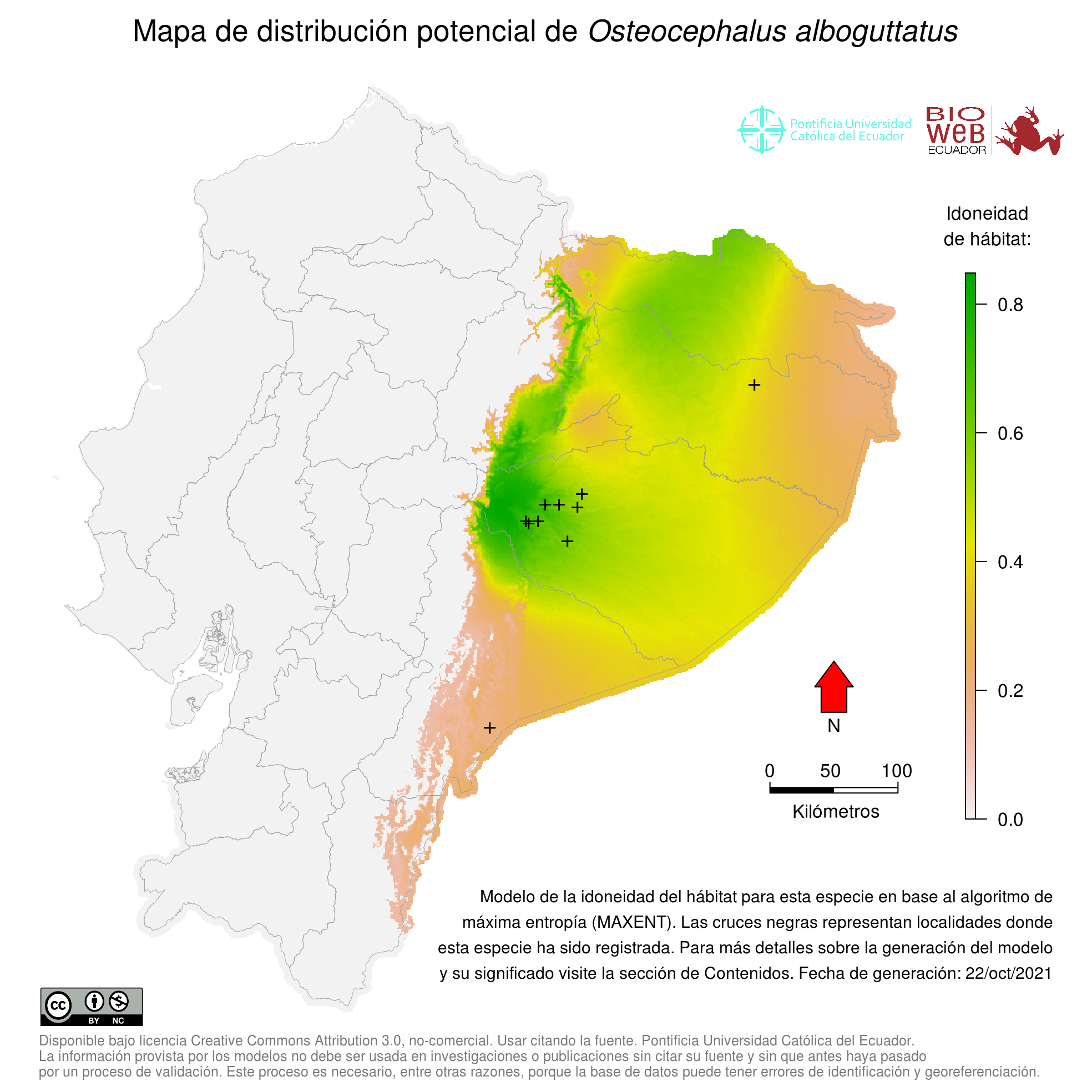
Distribution
Amazonía ecuatoriana (7).
Altitudinal Range
Hasta los 600 m sobre el nivel del mar (8).
Taxonomy and Evolutionary Relationships
Hasta el 2005, Osteocephalus alboguttatus fue incluído en el género Hyla. Faivovich et al. ( 4), no pudieron asignar a O. alboguttatus a un género por lo que fue reportado como insertae sedis. Wiens et al. ( 5) demostraron que esta especie es parte de Osteocephalus. Filogenias de Osteocephalus que incluyen a O. alboguttatus han sido publicadas por Moravec et al. ( 9), Ron et al. ( 1) y Wiens et al. ( 3). En la filogenia de Jetz y Pyron ( 10) es especie hermana del clado Osteocephalus heyeri + Osteocephalus subtilis.
Etymology
Del latín "albo" que significa blanco y "gutta" que significa punto. Presumiblemente, alboguttatus hace referencia a los puntos blancos de los flancos que son característicos de esta especie.
Additional Information
Hay una fotografía disponible en Calphotos.



Summary Author
Santiago R. Ron, Morley Read
Editor
Santiago R. Ron
Edition Date
2011-03-04T00:00:00
Update Date
2022-12-23T16:05:09.537
Literature Cited
Ron, S. R., Toral, E., Venegas, P. J. y Barnes, C. W. 2010. Taxonomic revision and phylogenetic position of Osteocephalus festae (Anura: Hylidae) with description of its larva. Zookeys 70:67–92.PDF Boulenger, G. A.1882. Catalogue of the Batrachia Salientia s. Ecaudata in the collection of the British Museum. Second Edition. London: Taylor & Francis 49530.PDF Wiens, J. J., Kuczynski, C. A., Hua, X. y Moen, D. S. 2010. An expanded phylogeny of treefrogs (Hylidae) based on nuclear and mitochondrial sequence data. Molecular Phylogenetics and Evolution 55:871-882.PDF Faivovich, J., Haddad, C. F., García, P. C., Frost, D. R., Campbell, J. A. y Wheeler, W. C. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History 294:1-240.PDF Wiens, J. J., Graham, C. H., Moen, D. S., Smith, S. A. y Reeder, T. W. 2006. Evolutionary and ecological causes of the latitudinal diversity gradient in hylid frogs: treefrog trees unearth the roots of high tropical diversity. American Naturalist 168:579-596.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Frost, D. R. 2010. Amphibian species of the world: an online reference. Version 5.4 (8 April, 2010). Electronic Database accessible at http://research.amnh.org/vz/herpetology/amphibia/. American Museum of Natural History, New York, USA. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Moravec , J., Aparicio, J., Guerrero-Reinhard, M., Calderón, G., Jungfer, K. y Gvozdik, V. 2009. A new species of Osteocephalus (Anura: Hylidae) from Amazonian Bolivia: first evidence of tree frog breeding in fruit capsules of the Brazil nut tree. Zootaxa 2215:37–54. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858. Ortiz, D., Hoskin, C., Werneck, F., Réjaud, A., Manzi, S., Fouquet, A., Ron, S. 2022. Historical biogeography highlights the role of Miocene landscape changes on the diversification of a clade of Amazonian tree frogs. Organisms Diversity & Evolution 1-20.
|
