|
Vernacular Name
Rana terrestre de Wagner
State/Provinces
Morona Santiago, Napo, Orellana, Zamora Chinchipe, Pastaza, Sucumbíos
Natural Regions
Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico, Bosque Montano Oriental
Identification
Es una rana mediana a grande de color café, labios con barras negras y blancas y vientre blanco cremoso con moteado gris. Presenta rebordes cutáneos en los dedos del pie, pliegues dorsolaterales inconspicuos y piel dorsal con numerosas espículas dispersas. En la Amazonía de Ecuador, Leptodactylus wagneri se asemeja más a las especies que tienen rebordes cutáneos en los dedos del pie ( Leptodactylus discodactylus, Leptodactylus petersii y Leptodactylus leptodactyloides). Leptodactylus discodactylus se diferencia por ser de menor tamaño ( LRC < 35 mm ) y por la presencia de discos redondeados y expandidos en la punta de los dedos del pie (ausentes en Leptodactylus wagneri). Heyer ( 7) indica que, ocasionalmente, algunos individuos de Leptodactylus wagneri presentan discos expandidos en la punta de los dedos del pie; en tales casos, Leptodactylus discodactylus se diferencia por presentar surcos longitudinales en la superficie dorsal de los discos (surcos ausentes en Leptodactylus wagneri). Leptodactylus petersii difiere por ser de menor tamaño ( LRC < 51 mm) y por presentar puntas ligeramente expandidas en los dedos (ausentes en Leptodactylus wagneri). Leptodactylus leptodactyloides también es más pequeña ( LRC < 46 mm) y se distingue por su coloración ventral, donde el moteado está restringido al tercio anterior del cuerpo (en todo el vientre de Leptodactylus wagneri). Se diferencia de Leptodactylus knudseni, Leptodactylus pentadactylus, Leptodactylus rhodomystax y Leptodactylus stenodema por la ausencia de pliegues dorsolaterales conspicuos (aunque presentes, los pliegues en Leptodactylus wagneri solo presentan crestas cortas y elevadas ubicadas lateralmente hacia los flancos; 3, 4, 6).( 7). Se diferencia del género Adenomera por ser más grande ( LRC < 29 mm en Adenomera), tener el Dedo I de la mano más largo que el Dedo II (dedos iguales en longitud en Adenomera) y presentar rebordes cutáneos en los dedos de los pies (ausentes en Adenomera) ( 3, 4). Otras especies simpátricas con las que Leptodactylus wagneri puede resultar similar son los craugastóridos ( Pristimantis) y ránidos ( Rana). Se diferencia de la mayoría de Pristimantis por su vientre liso y por carecer de discos expandidos en los dedos (vientre areolado y discos presentes en Pristimantis). Se diferencia de Rana por carecer de membrana interdigital entre los dedos del pie (extensa en Rana). En la Amazonía central, Leptodactylus wagneri se diferencia de Leptodactylus bolivianus (ausente en Ecuador) en que esta última carece de rebordes cutáneos en los dedos del pie ( 3).
Description
Es una rana de tamaño medio a grande y cuerpo robusto con la siguiente combinación de caracteres (modificado de Rodríguez y Duellman ( 3), Duellman ( 4), Heyer y Peters ( 5), Heyer ( 6)): (1) hocico redondeado; (2) piel del dorso con numerosas espículas pequeñas; presencia de crestas cortas y elevadas que se encuentran ubicadas lateralmente hacia los flancos; (3) dedos de manos y pies carecen de membrana y terminan en puntas estrechas; Dedo I de la mano más largo que el Dedo II; machos en reproducción tienen dos espinas nupciales en el prepolex de cada pulgar; (4) dedos de pies exhiben rebordes cutáneos;
Color in Life
Modificado de Rodríguez y Duellman ( 3), Duellman ( 4), Heyer y Peters ( 5), Heyer ( 6): (1) labios con barras color crema y marrón obscuro, las que son más discernibles en la esquina posterior del ojo, las barras claras se encuentran ligeramente teñidas de rosado; (2) una marca triangular generalmente se encuentra presente en el dorso de la cabeza con el ápice dirigido hacia atrás, este triángulo se encuentra bordeado por una línea delgada crema o gris pálida; una línea anaranjada rojiza se extiende desde la comisura de la boca y tímpano hacia el hombro; (3) dorso verde oliva apagado, café o gris llevando puntos o manchas irregulares cafés obscuras a negras, las cuales se encuentran entremezcladas con manchas ligeramente más claras que el color de fondo, pero estas últimas son casi indistintas; una línea negra irregular generalmente se encuentra en el área dorsolateral; (4) flancos presentan la misma coloración que el dorso pero más clara, en la cual una tonalidad rojiza débil es evidente; manchas negras a veces se encuentran dispersas en los flancos; (5) superficies dorsales de extremidades superiores e inferiores tienen la misma coloración que el cuerpo y presentan barras transversales indistintas, irregulares y más obscuras que el color de fondo; (6) superficies posteriores de muslos negras con manchas o puntos de color amarillo verdoso a bronce amarillento; (7) ingle, axila y superficies ventrales de muslos débilmente amarillentos; vientre y garganta blanco cremosos y generalmente exhiben un patrón de moteado marrón o gris obscuro, el cual es más prominente en individuos grandes; (8) algunos adultos de ambos sexos presentan áreas glandulares amarillas prominentes ventrolateralmente; (9) iris bronce verdoso apagado con una línea horizontal media café grisácea y reticulaciones negras.
Males Face Cloacal Length Average
promedio = 51.6 mm (rango 39.1–60.7; n = 110). Promedio para la Amazonía de Ecuador = 50.4 mm (rango 38.0–57.6; n = 9) (
Females Face Cloacal Length Average
promedio = 65.5 mm (rango 52.3–81.7; n = 82). Promedio para la Amazonía de Ecuador = 66.4 mm (rango 57.8–75.7; n = 10) (6, 28
Habitat and Biology
Leptodactylus wagneri es una especie terrestre y nocturna que ha sido registrada en una gran variedad de hábitats que incluyen claros de bosque, pantanos, ciénegas, bosque primario y secundario, y en el borde de pozas, riachuelos y lagos (3, 4, 9, 12, 21, 23); lo que sugiere que es una especie con alta capacidad de adaptación a cambios ambientales y probablemente sea una buena colonizadora (17). Sin embargo, Leptodactylus wagneri no fue una especie común en ninguno de los hábitats mencionados en Santa Cecilia, Ecuador (4); pero si lo fue en claros y bosque secundario en Iquitos, Perú (3). Aunque los adultos son primordialmente nocturnos, los juveniles suelen ser activos durante el día, especialmente después de fuertes lluvias (3). Individuos que fueron capturados en el día, se encontraban en la cercanía de riachuelos y bajo sombra en claros de bosque (4). Heyer y Peters (5) reportaron que Leptodactylus wagneri vive bajo rocas y troncos a lo largo de los bancos de riachuelos turbulentos, e inclusive escapa buceando en la corriente de agua. La especie también fue encontrada frecuentemente en el pasto y planicies pantanosas cerca de riachuelos. No existe segregación ecológica evidente entre grupos de edad, sin embargo, juveniles y adultos jóvenes fueron más abundantes en bancos de riachuelos, mientras que los adultos más viejos lo fueron en planicies que estaban a cierta distancia de los cursos de agua (5, 23). Por otra parte, una especie del complejo Leptodactylus podicipinus-wagneri fue encontrada exclusivamente en áreas riparias (cercanas a cursos de agua) en la Amazonía norte de Brasil (24). Toft y Duellman (9) reportaron que la especie fue común tanto en época lluviosa como seca en la Amazonía peruana. Los machos de Leptodactylus wagneri han sido encontrados vocalizando desde el margen de pozas dentro del bosque (4) y en el margen de pozas en pastizales (13, 17). En la Amazonía occidental (Ecuador), Heyer y Bellin (17) reportaron que machos de Leptodactylus wagneri no se congregan en coros para vocalizar; al contrario de lo reportado por Zimmerman (12) en la Amazonía central, donde la especie fue observada vocalizando en coros. Heyer (6) sugiere la existencia tanto de cantos de anuncio como de agresión, estos últimos son emitidos contra otros machos para defender sitios de vocalización. También reporta la existencia de considerable variación en el canto de anuncio de Leptodactylus wagneri, lo que sugiere que más que una señal codificante (con un mensaje específico para las hembras) parece ser una señal de localización, por lo que más estudios son necesarios para dilucidar este aspecto (6). Ha sido sugerido que la actividad de vocalización y éxito larval están correlacionados con lluvias fuertes en la Amazonía central de Perú (21) y Ecuador (17); sin embargo, en un estudio realizado en el Cuzco amazónico, sureste de Perú (11), se encontró que la mayoría de leptodactílidos estuvieron ausentes en época seca, con excepción de Leptodactylus wagneri y Edalorhina perezi, aunque este último estudio no especifica si la actividad fue reproductiva.Los renacuajos llegan alcanzar una longitud de 35 mm (3) y se alimentan mordisqueando hojas de pasto de manera frenética (17). Renacuajos de Leptodactylus wagneri han sido encontrados entre vegetación densa en una poza superficial llena de maleza y en pozas semipermamenentes (4). Los renacuajos se congregan masivamente en escuelas extremadamente activas, las cuales pueden moverse distancias considerables y fusionarse con otras escuelas (17). Los renacuajos pueden ser presa de insectos como larvas de odonatos, así como de coleópteros y hemípteros acuáticos (17). Es una especie con un amplio nicho, por lo que se encuentra en simpatría y sintopía con otras especies de Leptodactylus. Es conocido que Leptodactylus wagneri se encuentra en las mismas áreas generales que Leptodactylus petersii y Leptodactylus leptodactyloides, en formaciones de vegetación abierta (claros), así como también en bosque de dosel cerrado (6). En planicies pantanosas, es sintópica con Leptodactylus discodactylus; en estas circunstancias, Leptodactylus wagneri generalmente es más abundante (5). La especie muestra también un amplio solapamiento de nicho con Leptodactylus mystaceus y Leptodactylus knudseni; sin embargo, los machos de Leptodactylus wagneri y Leptodactylus mystaceus vocalizan desde diferentes microhábitats dentro del mismo hábitat general (claros de bosque) (17). Por otro lado, Leptodactylus wagneri muestra un solapamiento de nicho bajo a moderado con Leptodactylus discodactylus y Leptodactylus pentadactylus (17).
Reproduction
Las puestas son grandes y contienen entre 1726–1749 huevos pequeños y pigmentados, de 1.0–1.5 mm de diámetro, los mismos que son depositados en nidos de espuma sobre la superficie de cuerpos de agua lénticos (3, 4, 17). El tipo de puesta y sus renacuajos acuáticos la ubican en el Modo reproductivo 5 (10). Duellman (4) reportó que el 50% de las hembras encontradas en Santa Cecilia, Ecuador estaban grávidas. De estas, 7 hembras con LRC promedio = 67.3 mm (rango 51.0–77.0) contuvieron en promedio 1588.6 (rango 1000–3150) huevos ováricos maduros. Heyer y Bellin (17) reportaron que 5 hembras contuvieron un número similar: 2793–3602 huevos ováricos. Dentro del nido de espuma, los embriones eclosionan y los pequeños renacuajos se sumergen en el agua 2 días después de la fertilización (17). Heyer (25) y Prado et al. (16) postularon que Leptodactylus y Adenomera constituyen un grupo que ha experimentado transición desde el medio acuático hacia el terrestre, y que la gran diversidad de los sitios de oviposición de nidos de espuma entre especies abarca un amplio rango de esta transición. Siguiendo este razonamiento, los grupos de especies desde el más primitivo al más derivado son: melanonotus + ocellatus (nido en la superficie del agua), pentadactylus (nidos en cavidades adyacentes al agua), fuscus (nidos en cámaras de incubación y larva acuática), y Adenomera (nidos en cámaras de incubación y larva no acuática). También existe una relación en reducir el tamaño de la puesta y aumentar el diámetro de los huevos conforme un grupo es más terrestre (25).
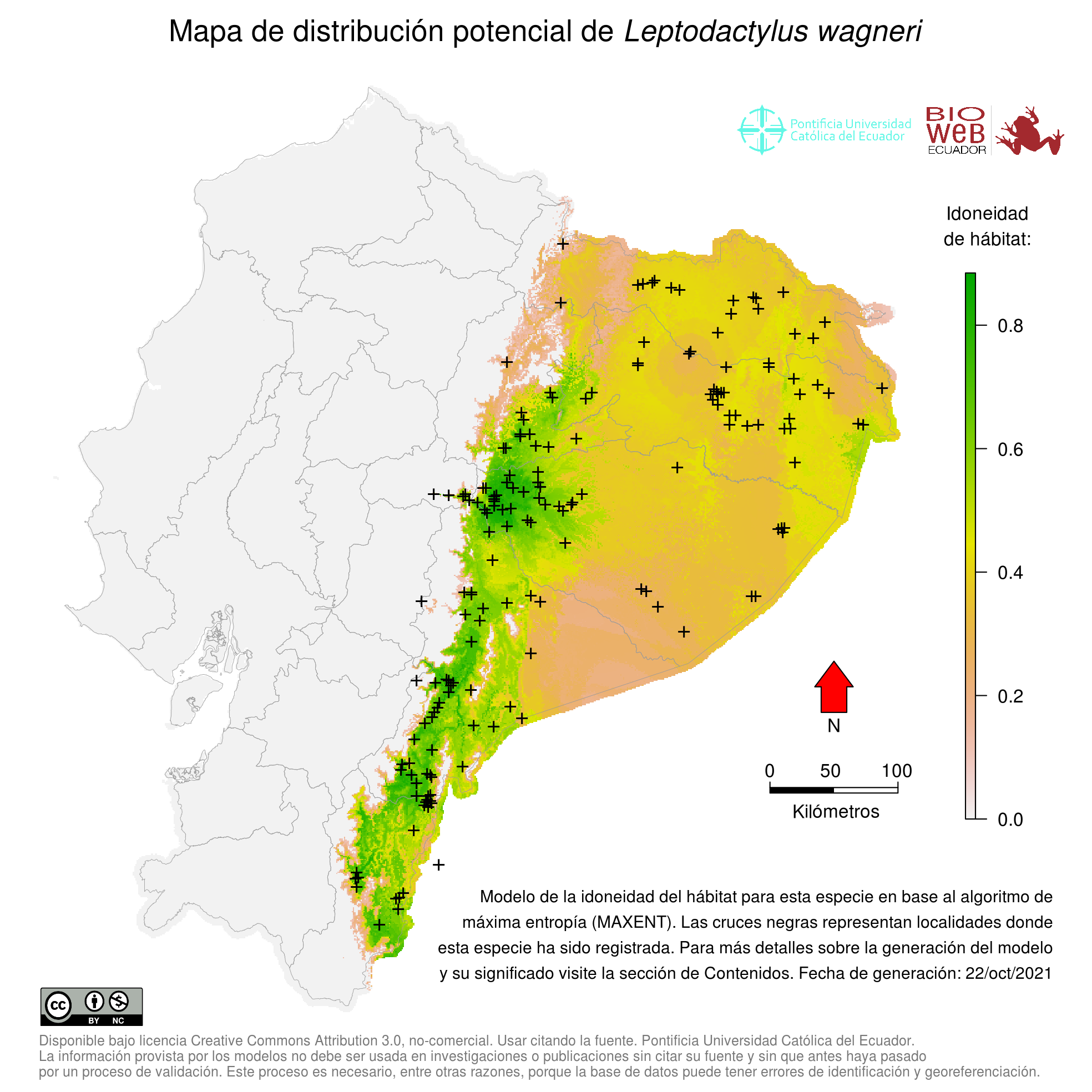
Distribution
Leptodactylus wagneri se distribuye en la Cuenca Amazónica superior (6); sin embargo, ha sido sugerido que presenta una distribución heterogénea con poblaciones disyuntas presentes en Colombia meridional, Amazonía de Ecuador, norte de Perú y Brasil occidental (Estado de Acre) (20, 27). En efecto, la gran mayoría de especímenes de esta especie examinados por Heyer (6) en su revisión del complejo podicipinus-wagneri, provinieron de Colombia, Ecuador y Perú. De la Riva et al. (8) reportaron ausencia de registros de esta especie en Bolivia.
Altitudinal Range
De 200 a 1800 m sobre el nivel del mar (20).
Taxonomy and Evolutionary Relationships
Leptodactylus wagneri está cercanamente relacionado a Leptodactylus colombiensis (27, 29) Forma parte del grupo de especies Leptodactylus melanonotus (6, 25, 27, 29)
Etymology
El nombre específico “wagneri” es un patronímico para el naturalista, colector y botánico alemán, Dr. Moritz Wagner (27).
Additional Information
Heyer (7) la incluye en su clave de identificación para individuos adultos del grupo melanonotus. Heyer y Peters (5) la incluyen en su clave de identificación para individuos adultos de Leptodactylus en Ecuador. Bogart (15) indican que el cariotipo 2N = 22 cromosomas consiste en 2 pares de cromosomas metacéntricos, 4 pares submetacéntricos, un par subtelocéntrico y 4 pares acrocéntricos. Por otra parte, Heyer y Diment (14) encontraron ciertas diferencias con Bogart (15) en cuanto a la configuración pero no en el número de cromosomas: 2N = 22 (2 pares de cromosomas metacéntricos, 2 pares submetacéntricos, 3 pares subtelocéntricos y 4 pares acrocéntricos). Sugieren que las diferencias encontradas probablemente reflejen diferentes interpretaciones del material, por lo que esta información debe ser analizada con precaución (14). Straughan y Heyer (26) describen el canto y reportan la existencia de considerable variación geográfica del mismo. Hödl (13) describen el canto de la Amazonía central, acompañado de un oscilograma y audioespectrograma. Duellman (4) presenta fotografías en vista dorso-lateral de un juvenil y un adulto, y describe un renacuajo de Santa Cecilia, Ecuador; mientras que Rodríguez y Duellman (11) presentan una fotografía en vista dorso-lateral de un espécimen de Iquitos, Perú. Wassersug y Heyer (22) describen la morfología de la cavidad oral del renacuajo. Valencia et al. (2) la incluyen en su guía de campo. Maxson y Heyer (19) realizan un análisis bioquímico de albúminas para varias especies de Leptodactylus, dando soporte a la distinción de los grupos de especies pentadactylus y melanonotus y sugieren que la mayor diversificación en Leptodactylus ocurrió durante el Paleoceno (65.5–55.5 millones de años). Heyer (25) propone una representación diagramática de las relaciones entre grupos de especies dentro de Leptodactylus. Heyer (6) comentó que los adultos del complejo Leptodactylus podicipinus-wagneri presentan caracteres distintivos pero no discretos. Sin embargo, también sugirió que la variación puede ser más significativa entre renacuajos que entre adultos dentro del complejo.



Summary Author
Diego A. Ortiz, Morley Read, Andrea Varela-Jaramillo y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2013-10-23T00:00:00
Update Date
2022-09-26T20:38:17.973
Literature Cited
Peters, W. K. 1862. Über die batrachier-Gattung Hemiphractus. Monatsberichte der Preussischen Akademie der Wissenschaften zu Berlin 1862:144-152. Valencia, J., Toral, E., Morales, M., Betancourt, R. y Barahona, A. 2009. Guía de campo de anfibios del Ecuador. Fundación Herpetológica Gustavo Orcés, Simbioe. Maxigraf S. A., Quito 208. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Heyer, W. R. y Peters, J. A. 1971. The frog Genus Leptodactylus in Ecuador. Proceedings of the Biological Society of Washington 84:163-170. Heyer, W. R. 1994. Variation within the Leptodactylus podicipinus-wagneri complex of frogs (Amphibia: Leptodactylidae). Smithsonian Contributions to Zoology 546:1-124.PDF Heyer, W. R. 1970. Studies on the frogs of the genus Leptodactylus (Amphibia: Leptodactylidae). VI. Biosytematics of the melanonotus group. Los Angeles County Museum Contributions in Science:1-48.PDF De la Riva, I., Köhler, J., Lötters, S. y Reichle, S. 2000. Ten years of research on Bolivian amphibians: updated checklist, distribution, taxonomic problems, literature and iconography. Revista Española de Herpetología 14:19-164.PDF Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Crump, M. 1974. Reproductive strategies in a tropical anuran community. Miscellaneous Publications of the Museum of Natural History. University of Kansas 61:1-68.PDF Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Zimmerman, B. L. 1983. A Comparison of Structural Features of Calls of Open and Forest Habitat Frog Species in the Central Amazon. Herpetologica 39:235-246 . Hödl, W. 1977. Call Differences and Calling Site Segregation in Anuran Species from Central Amazonian Floating Meadows. Oecologia 28:351-363.PDF Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Prado, C. P. A., Uetanabaro, M., Haddad, C. F. B. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae) with a review on the reproductive specialization toward terrestriality in the genus. Copeia 2002:1128-1133.PDF Heyer, W. R. y Bellin, M. S. 1973. Ecological Notes on Five Sympatric Leptodactylus (Amphibia, Leptodactylidae) from Ecuador. Herpetologica 29:66-72.PDF Amaro-Ghilardi, R. C., Skuk, G., de Sá, R., Rodrígues, M. T. y Yonenaga-Yassuda, Y. 2006. Karyotypes of eight species of Leptodactylus (Anura, Leptodactylidae) with a description of a new karyotype for the genus. Phyllomedusa 5:119-133. Maxson, L. R. y Heyer, W. R. 1988. Molecular systematics of the frogs genus Leptodactylus (Amphibia: Leptodactylidae). Fieldiana, Zoology, New Series 41:1-13. IUCN. 2010. The IUCN red list of threatened species. Sibon dunni. http://www.iucnredlist.org/apps/redlist/details/177554/0. (Consultado: 2011). Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Wassersug, R. J. y Heyer, W. R. 1988. A survey of internal oral features of leptodactyloid larvae (Amphibia: Anura). Smithsonian Contributions to Zoology 457:1-99. Duellman, W. E. y Mendelson III, J. R. 1995. Amphibians and reptiles from northern departamento Loreto, Peru: Taxonomy and biogeography. University of Kansas Science Bulletin 55:329-376.PDF Ribeiro, J. W., Lima, A. P., Magnusson, W. E. 2012. The effect of riparian zones on species diversity of frogs in Amazonian forests. Copeia 2012:375-381. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF Straughan, I. R. y Heyer, W. R. 1976. A functional analysis of the mating calls of the Neotropical frog genera of the Leptodactylus complex (Amphibia, Leptodactylidae). Papéis Avulsos de Zoologia 29:221-245. de Sá, R., Grant, T., Camargo, A., Heyer, W. R., Ponssa, M. L., Stanley, E. 2014. Systematics of the neotropical genus Leptodactylus Fitzinger, 1826 (Anura: Leptodactylidae): phylogeny, the relevance of non-molecular evidence, and species accounts. South American Journal of Herpetology 9:S1-S128. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Gazoni, T., Lyra, M., Ron, S., Strüssmann, C., Baldo, D., Narimatsu, H., Pansonato, A., Schneider, R., Giaretta, A., Haddad, C., Parise-Maltempi, P., de Carvalho, T. 2021. Revisiting the systematics of the Leptodactylus melanonotus group (Anura: Leptodactylidae): Redescription of L. petersii and revalidation of its junior synonyms. Zoologischer Anzeiger 290: 117—134.
|




 Map of Life
Map of Life



