|
Vernacular Name
Rana terrestre de Moti
State/Provinces
Orellana, Sucumbíos, Pastaza, Napo
Natural Regions
Bosque Montano Oriental, Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
Es una rana grande de color café con pequeñas manchas oscuras, ingles cafés con una zona interna amarilla y muslos con manchas anaranjadas. Presenta cabeza ancha, pliegues dorsolaterales conspicuos y carece de discos expandidos y rebordes cutáneos en los dedos. En la Amazonía de Ecuador, Leptodactylus stenodema es similar a especies del grupo Leptodactylus pentadactylus; Pyburn y Heyer ( 18)): Leptodactylus mystaceus, Leptodactylus rhodomystax, Leptodactylus knudseni y Leptodactylus pentadactylus. Leptodactylus mystaceus y Leptodactylus rhodomystax tienen líneas supralabiales blancas y anchas (ausentes en Leptodactylus stenodema) ( 5, 11). Leptodactylus knudseni y Leptodactylus pentadactylus presentan un tamaño similar y manchas verticales obscuras en el labio superior como en Leptodactylus stenodema; sin embargo, Leptodactylus stenodema se diferencia por carecer de manchas transversales entre los ojos y entre los pliegues dorsolaterales y de una línea negra entre la narina y el ojo (presentes en Leptodactylus knudseni y Leptodactylus pentadactylus) ( 4, 5, 11, 15, 18). Más aún, Leptodactylus stenodema se diferencia de Leptodactylus knudseni por la ausencia de espinas cornificadas en el pulgar y pecho de machos reproductivos (presentes en Leptodactylus knudseni). Además, sus pliegues dorsolaterales son contorneados de obscuro y alcanzan la ingle (no contorneados de obscuro y alcanzan únicamente el sacro en Leptodactylus knudseni) ( 11, 18). Se diferencia de Leptodactylus pentadactylus por la coloración y disposición de los pliegues dorsolaterales. Leptodactylus stenodema tiene el dorso de color café rojizo o café verdoso apagado uniforme, y el vientre es café claro grisáceo ( Leptodactylus pentadactylus tiene el dorso usualmente anaranjado o café claro rojizo, con distintivas manchas transversales cafés obscuras, y el vientre es obscuro con manchas redondeadas blanquecinas). El pliegue dorsolateral es continuo con el pliegue supratimpánico y es contorneado de negro en Leptodactylus stenodema (pliegue dorso-lateral es distinto del pliegue supratimpánico en Leptodactylus pentadactylus) ( 5, 11, 18). En Leptodactylus stenodema la superficie posterior de los muslos es de color obscuro uniforme con pequeñas manchas anaranjadas ( Leptodactylus pentadactylus tiene manchas y vermiculaciones blancas conspicuas sobre un fondo negro) ( 18). Leptodactylus stenodema también puede ser similar a Rana palmipes pero se diferencia por tener el dorso café rojizo y membrana basal entre los dedos de los pies ( Rana palmipes presenta un dorso verde grisáceo y membrana interdigital extensa entre los dedos el pie) ( 5).
Description
Especie de tamaño grande que presenta la siguiente combinación de caracteres (modificado de Rodríguez y Duellman ( 4), Duellman ( 5), Heyer ( 11), Lima et al. ( 15), Pyburn y Heyer ( 18)): (1) cabeza grande y ancha con hocico redondeado; canto rostral poco definido; (2) cuerpo robusto y extremidades cortas y robustas; (3) piel del dorso lisa; (4) pliegue supratimpánico continuo con el pliegue dorso-lateral que se extiende hasta la ingle; ambos pliegues son contorneados de negro; pliegue desde encima del tímpano hacia un lado del cuerpo ausente; (5) dedos de manos y pies sin membranas y rebordes cutáneos; (6) machos reproductivos carecen de espinas cornificadas en el pulgar y pecho; (7) superficie dorsal de pantorrilla y parte distal del tarso con varios tubérculos blancos con puntas negras; planta del pie usualmente lisa, a veces con tubérculos blancos dispersos que pueden llevar o no puntas negras.
Color in Life
Modificado de Rodríguez y Duellman ( 4), Duellman ( 5), Heyer ( 11), Lima et al. ( 15), Pyburn y Heyer ( 18): (1) una mancha café obscura cubre cada narina; ausencia de línea canthal obscura entre el narina y el ojo; aproximadamente 4 barras obscuras están presentes en el labio superior, una de estas llega hasta la órbita; (2) dorso café rojizo, café amarillento o café verdoso uniforme con pequeñas manchas obscuras; la coloración se torna más obscura hacia la parte posterior; ausencia de barras obscuras transversales o un patrón distintivo entre los ojos o entre los pliegues dorsolaterales; (3) flancos de color café apagado dorsalmente y café anaranjado ventralmente; manchas obscuras pueden estar presentes en flancos e ingle; glándula grande de color amarillo apagado se extiende desde la mitad del flanco hacia la parte superior de la ingle; (4) garganta gris violácea o café obscura; otras superficies ventrales son grisáceas y pueden llevar numerosas manchas claras; (5) superficie dorsal de extremidades uniformemente café grisácea obscura con líneas transversales negras estrechas e indistintas; (6) superficie posterior de muslos gris violácea obscura uniforme con o sin pequeñas manchas anaranjadas y puntos de color crema; una glándula rojiza elongada se extiende diagonalmente desde cerca de la cloaca hasta la rodilla; (7) planta del pie y palma de mano son de color gris violáceo obscuro; (8) iris es bronce dorsalmente y anaranjado ventralmente, con una línea media horizontal roja.
Males Face Cloacal Length Average
promedio = 89.9 mm (rango 83.0–99.7) (11
Females Face Cloacal Length Average
promedio = 91.1 mm (rango 82.0–100.3) (11
Habitat and Biology
Especie terrestre diurna y nocturna que habita en bosque primario de tierra firme, aunque también ha sido registrada menos frecuentemente en bosque secundario (5, 15). En la Amazonía Central, Brasil, la especie fue encontrada mayormente en suelos ácidos (23) y la reproducción ocurre durante todo el año en agujeros subterráneos, probablemente escarbados por el macho (15). Los agujeros son un sistema de ramificación de túneles, probablemente no excavado por la rana, que puede alcanzar 1 m o más debajo de la superficie y tener varias entradas. Cuando son iluminados en la noche sus ojos producen un reflejo rojo (15).
Reproduction
Probablemente, la pareja en amplexus deposita un nido de espuma en un agujero y los renacuajos se desarrollan dentro del mismo (15).
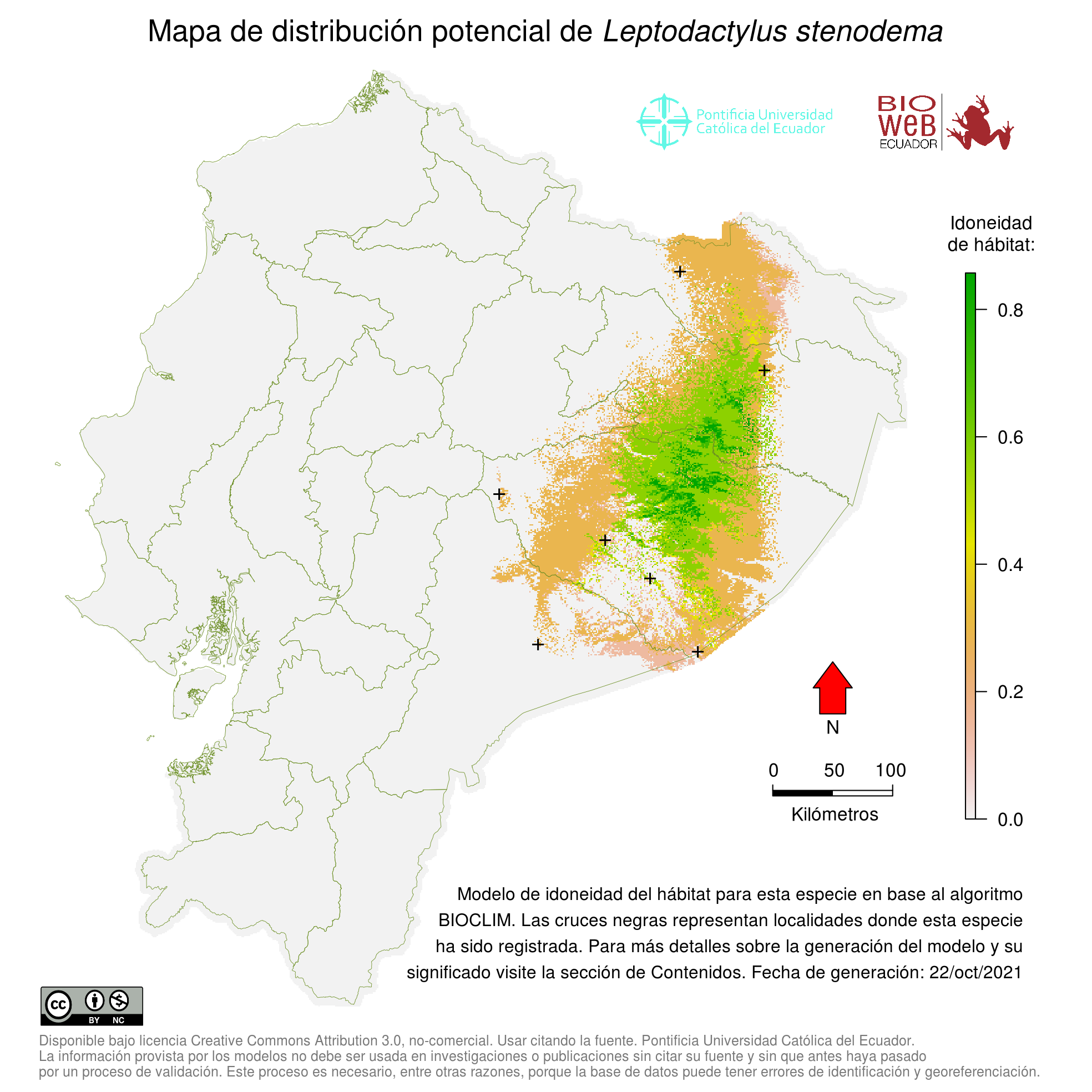
Distribution
Se distribuye ampliamente en la Amazonía Occidental y Central, desde Colombia meridional, Ecuador, Perú hacia el este hasta Brasil y Guyanas ( 11, 21, 26). Su presencia en la Estación Tiputini USFQ, reportada por Cisneros-Heredia ( 27), requiere ser documentada. Un registro fotográfico de la cuenca del Río Pastaza por Ortega-Andrade ( 28) en realidad corresponde a otra especie de Leptodactylus.
Altitudinal Range
De 0 a 1200 m sobre el nivel del mar (20).
Taxonomy and Evolutionary Relationships
Está cercanamente relacionado con Leptodactylus flavopictus, Leptodactylus vastus y Leptodactylus paraensis. Forma parte del grupo de especies Leptodactylus pentadactylus ( 2, 11, 26). En la filogenia de Jetz y Pyron ( 25) Leptodactylus stenodema está cercanamente relacionada a Leptodactylus knudseni, Leptodactylus pentadactylus, Leptodactylus myersi, Leptodactylus fallax y Leptodactylus labyrinthicus.
Etymology
Su nombre deriva el griego stenos que significa estrecho y demás que significa cuerpo; en referencia a su cuerpo angosto.
Additional Information
Heyer y Peters (6) designan un lectotipo para la especie. Pyburn y Heyer (18), en base a especímenes de Ecuador y Colombia, describen características morfológicas, de identificación, canto (acompañado de un audioespectrograma), ecología y una fotografía en vida de un individuo en vista dorsolateral. Duellman (5) y Rodríguez y Duellman (4) presentan un relato y fotografías en vista dorsolateral de individuos de Santa Cecilia, Ecuador e Iquitos, Perú, respectivamente. Zimmerman (7) realiza una comparación de la estructura del canto entre especies de bosque (incluida aquí Leptodactylus stenodema) vs. especies de áreas abiertas en la Amazonía Central, Brasil, indicando que las especies de bosque tienen una Longitud Rostro-cloacal mayor y una frecuencia dominante más baja que especies de áreas abiertas. Hero y Galatti (12) presentan un audioespectrograma del canto de anuncio y lo comparan con el de Leptodactylus pentadactylus y Leptodactylus knudseni. Heyer (11) proporciona una lista de caracteres y una clave dicotómica de identificación para adultos del grupo pentadactylus, e ilustra también los diferentes patrones de coloración del dorso, cabeza y extremidades posteriores dentro del grupo. Presenta también una descripción del canto de anuncio acompañada de un audioespectrograma y un oscilograma de Leptodactylus stenodema. La frecuencia dominante es de 120-680 a 760-900 Hz. La duración del canto es de 0.26-0.36 s con multipulsos por nota. Estructura armónica ausente. Lescure y Marty (8) proporcionaron una foto y un escrito de especímenes de Guyana Francesa. Von May (19) proveen un registro de Perú, y comentan sobre su distribución. Heyer et al. (13) presenta una hipótesis filogenética del grupo pentadactylus; sin embargo, no incluyen en su estudio a Leptodactylus stenodema. Lima et al. (15) proveen fotografías en vista dorsolateral y ventral de un macho, de la superficie posterior de muslos, de una hembra en vista dorsolateral, y de la posición de defensa. Menin et al. (23) analizan el efecto de la topografía y características del suelo sobre la distribución de varias especies de anuros no dependientes del agua para su reproducción en la Amazonía Central. Estos autores indican que las especies son generalistas y que las comunidades muestran poca variación en relación a las características del hábitat; sin embargo, Leptodactylus stenodema fue encontrada mayormente en suelos ácidos (23). Valencia et al. (3) la incluyen en su guía de campo. Ouboter y Jairam (22) comentan sobre su distribución en Surinam. Maxson y Heyer (17) realizan un análisis bioquímico de albúminas para varias especies de Leptodactylus y sugieren que la mayor diversificación en Leptodactylus ocurrió durante el Paleoceno (65.5–55.5 millones de años). Heyer (24) propone una representación diagramática de las relaciones entre grupos de especies dentro de Leptodactylus. Heyer (24) y Prado et al. (14) postularon que Leptodactylus y Adenomera constituyen un grupo que ha experimentado transición desde el medio acuático hacia el terrestre y que la gran diversidad de los sitios de oviposición de nidos de espuma entre especies abarca un amplio rango de esta transición. Siguiendo este razonamiento, los grupos de especies desde el más primitivo al más derivado son: melanonotus + ocellatus (nido en la superficie del agua), pentadactylus (nidos en cavidades adyacentes al agua), fuscus (nidos en cámaras de incubación y larva acuática), y Adenomera (nidos en cámaras de incubación y larva no acuática). También existe una relación en reducir el tamaño de la puesta y aumentar el diámetro de los huevos conforme un grupo es más terrestre (24).

Summary Author
Diego A. Ortiz, Morley Read, Andrea Varela-Jaramillo y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2018-08-17T00:00:00
Update Date
2022-09-26T20:33:32.057
Literature Cited
Jiménez de la Espada, M. 1875. Vertebrados del viaje al Pacífico verificado de 1862 a 1865 por una comisión de naturalistas enviada por el gobierno Español. Batracios 208. Heyer, W. R. 1972. The status of Leptodactylus pumilio Boulenger (Amphibia, Leptodactylidae) and the description of a new species of Leptodactylus from Ecuador. Contributions in Science 231:1-8.PDF Valencia, J., Toral, E., Morales, M., Betancourt, R. y Barahona, A. 2009. Guía de campo de anfibios del Ecuador. Fundación Herpetológica Gustavo Orcés, Simbioe. Maxigraf S. A., Quito 208. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Heyer, W. R. y Peters, J. A. 1971. The frog Genus Leptodactylus in Ecuador. Proceedings of the Biological Society of Washington 84:163-170. Zimmerman, B. L. 1983. A Comparison of Structural Features of Calls of Open and Forest Habitat Frog Species in the Central Amazon. Herpetologica 39:235-246 . Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Heyer, W. R. 1979. Systematics of the pentadactylus species group of the frog genus Leptodactylus (Amphibia: Leptodactylidae). Smithsonian Contributions to Zoology 301:1-43.PDF Hero, J. M. y Galatti, U. 1990. Characteristics Distinguishing Leptodactylus pentadactylus and L. knudseni in the Central Amazon Rainforest. Journal of Herpetology 24:226-228.PDF Heyer, W. R., de Sá, R. y Rettig, A. 2005. Sibling Species, Advertisment Calls and Reproductive Isolation, in Frogs of the Leptodactylus pentadactylus Species Cluster (Amphibia, Leptodactylidae). Herpetologia Petropolitana, Ananjeva N. and Tsinenko O. (eds.) 35-39.PDF Prado, C. P. A., Uetanabaro, M., Haddad, C. F. B. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae) with a review on the reproductive specialization toward terrestriality in the genus. Copeia 2002:1128-1133.PDF Lima, A. P., Magnusson, W. E., Menin, M., Erdtmann, L., Rodrigues, D. J., Keller, C., Hödl, W. 2006. Guia de sapos da Reserva Adolpho Ducke, Amazônia Central = Guide to the frogs to Reserva Adolpho Ducke, Central Amazonia. Átemma, Manaus. 168 p. Amaro-Ghilardi, R. C., Skuk, G., de Sá, R., Rodrígues, M. T. y Yonenaga-Yassuda, Y. 2006. Karyotypes of eight species of Leptodactylus (Anura, Leptodactylidae) with a description of a new karyotype for the genus. Phyllomedusa 5:119-133. Maxson, L. R. y Heyer, W. R. 1988. Molecular systematics of the frogs genus Leptodactylus (Amphibia: Leptodactylidae). Fieldiana, Zoology, New Series 41:1-13. Pyburn, W. y Heyer, W. R. 1975. Identity and call of the frog, Leptodactylus stenodema. Copeia 1975:585-587. von May, R. 2004. Geographic distribution: Leptodactylus stenodema. Herpetological Review 35:282. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Frost, D. R. 2013. Amphibian Species of the World: an online reference. Version 5.6 (15 October, 2012). Base de datos accesible en http://research.amnh.org/vz/herpetology/amphibia/ American Museum of Natural History, New York, USA. Ouboter, P. E. y Jairam, R. 2012. Amphibians of Suriname. Brill. 388 pp. Menin, M., Lima, A. P., Magnusson, W. E., Waldez, F. 2007. Topographic and edaphic effects on the distribution of terrestrially reproducing anurans in Central Amazonia: mesoscale spatial patterns. journal of Tropical Ecology 23:539-547. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858. de Sá, R., Grant, T., Camargo, A., Heyer, W. R., Ponssa, M. L., Stanley, E. 2014. Systematics of the neotropical genus Leptodactylus Fitzinger, 1826 (Anura: Leptodactylidae): phylogeny, the relevance of non-molecular evidence, and species accounts. South American Journal of Herpetology 9:S1-S128. Cisneros-Heredia, D. F. 2006. La herpetofauna de la Estación de Biodiversidad Tiputini, Amazonía Ecuatoriana Ecología de una comunidad taxonómicamente diversa, con comentarios sobre metodologías de inventario. Universidad San Francisco de Quito, 1-21. Ortega-Andrade, H. M. 2010. Anfibios y reptiles de la Centro-Amazonía de Ecuador: Los territorios indígenas Achuar, Shiwiar y Sápara de la Cuenca del Río Pastaza. Museo Ecuatoriano de Ciencias Naturales y Fundación Ecociencia, Quito, Ecuador.PDF
|




 Map of Life
Map of Life

