|
Vernacular Name
Rana enana de Peters
State/Provinces
Napo, Orellana, Pastaza, Sucumbíos, Zamora Chinchipe
Natural Regions
Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
Es una rana pequeña a mediana de color café con cuerpo rechoncho, cabeza pequeña, tubérculos dorsales rojizos, pecho gris, parte posterior del vientre, superficies ventrales y ocultas de muslos y pantorrillas blancas, con extenso moteado negro, flancos anaranjados hacia la ingle y un punto negro conspicuo sobre la ingle. La presencia de un tubérculo tarsal y la ausencia de dientes maxilares permiten distinguir a Engystomops petersi de Engystomops pustulatus, Engystomops guayaco, Engystomops montubio, Engystomops coloradorum, Engystomops randi y Engystomops puyango (3). Estas especies se encuentran en las tierras bajas de la Costa de Ecuador y Perú, y tienen el Dedo I de la mano más corto o igual que el Dedo II (Dedo I más largo que el Dedo II en Engystomops petersi). En la Amazonía de Ecuador, Engystomops petersi es similar a especies e individuos pequeños de la familia Bufonidae. Rhinella difiere por la presencia de crestas craneales y por la piel granular del vientre (crestas ausentes y vientre liso en Engystomops petersi). Amazophrynella siona se distingue por no tener tubérculos pequeños rojos en el dorso y el vientre con manchas rojas a amarillas (vientre blanco moteado con negro en Engystomops petersi) (9). Edalorhina perezi resulta muy similar a Engystomops petersi por la presencia de un dorso tuberculado, una ingle anaranjada y vientre moteado blanco y negro, sin embargo, esta presenta un cuerpo aplanado, flancos negros (café obscuros a crema en Engystomops petersi), tubérculos cónicos en los párpados (ausentes en Engystomops petersi) y la garganta y pecho blanco (grises en Engystomops petersi) (8). Otras especies similares a Engystomops petersi que habitan al este de los Andes pero están ausentes en Ecuador incluyen a Engystomops pustulosus y Engystomops freibergi. Engystomops pustulosus se diferencia por tener la glándula en el flanco más alargada, una membrana timpánica tuberculada, un patrón de tubérculos en el dorso que consiste de tubérculos grandes y pequeños dispersos aleatoriamente, o los tubérculos grandes se encuentran formando filas longitudinales o chevrones y por carecer de puntos inguinales negros grandes (presentes en Engystomops petersi). Engystomops freibergi tiene extremidades posteriores proporcionalmente más pequeñas y un dorso y una cabeza más anchos que Engystomops petersi. La duración promedio del canto en Engystomops petersi es significativamente más larga y tiene una frecuencia promedio más alta que en Engystomops freibergi (16).
Description
Es una rana de tamaño pequeño a mediano con la siguiente combinación de caracteres (modificado de Duellman ( 9); Rodríguez y Duellman ( 8); Funk et al. ( 16)): (1) hocico corto y puntiagudo en vista dorsal y sobresaliente con el margen anterior del labio ubicado posteriormente a la narina en vista lateral; (2) tímpano liso; anillo timpánico generalmente bien definido, al menos ventralmente; (3) Dedo I de la mano más largo que el Dedo II; (4) almohadillas nupciales presentes; (5) membrana interdigital ausente en manos y pies; (6) tubérculo tarsal presente; (7) dorso con tubérculos pequeños y grandes dispersos, a veces formando filas divergentes en las regiones occipital y escapular; superficies ventrales lisas; glándulas parotoideas y del flanco presentes y elípticas; (8) dientes maxilares ausentes; odontóforos y dientes vomerinos ausentes; proceso dentígero del vómer delgado y puntiagudo (a manera de espina); (9) machos tienen un saco subgular grande y medio; (10) renacuajos alcanzan una longitud de 26 mm, 60% de la longitud corresponde a la cola.
Color in Life
Tubérculos pequeños del dorso rojos o anaranjados, contrastan con el color de fondo que varía de gris obscuro a café apagado. Algunos individuos adicionalmente tienen puntos café obscuros en el dorso. Palidez en el hocico y flancos puede estar presente (morfo pálido) o ausente, el “morfo pálido” es más frecuente en hembras que en machos. Flancos se tornan anaranjados posteriormente hacia la ingle en individuos grandes. Puntos negros grandes presentes a nivel de la ingle. Barra café obscura transversa presente en el muslo y pantorrilla. Superficie anterior y posterior de los muslos moteada de negro con crema. Parte posterior del vientre y superficies ventrales de muslos blancas o grises con fuerte moteado negro, tamaño y número de marcas negras incrementa hacia la ingle. Garganta y pecho grises obscuros con pequeñas manchas bancas, cantidad de manchas blancas incrementa hacia la parte posterior del pecho donde se fusiona con la coloración blanca del abdomen. Algunos individuos tienen moteado anaranjado débil en la garganta y pecho. Usualmente, una línea media delgada color crema se extiende desde la punta del hocico hasta el vientre, aunque en algunos individuos esta línea es débil. Iris bronce apagado. Cuerpo y musculatura de la cola de los renacuajos negra con manchas cremas en la cola y aletas grises (8, 9, 17)
Males Face Cloacal Length Average
Promedio = 26.8 mm (rango 20.6–31.3; n = 127) (17
Females Face Cloacal Length Average
Promedio = 30.9 mm (rango 25.2–39.1; n = 60) (17
Habitat and Biology
Habita bosque húmedo primario y áreas más alteradas como bosque secundario, borde de bosque y claros. Es nocturna y terrestre (8, 9, 10). Parece estar distribuida heterogéneamente a través de la selva tropical de tierras bajas, ya que puede ser abundante en algunos sitios (23), pero está ausente en otros sitios aparentemente apropiados (17). En la Amazonía peruana, fue rara tanto en época seca como lluviosa (10, 13). Sin embargo, Aichinger (12) reporta que se reproduce principalmente en época seca. Observaciones limitadas indicarían que existe segregación ecológica espacial entre adultos y juveniles, pues durante la noche, los adultos han sido mayormente observados activos en el suelo del bosque, mientras que los juveniles se han encontrado durmiendo en vegetación baja (9). Su dieta incluye exclusivamente termitas (9). En la Amazonía de Ecuador, vive en simpatría con otras tres especies crípticas de Engystomops aún no descritas (25).
Reproduction
La reproducción ocurre en bordes de lagos, charcas y pozas (8, 9, 12). Los machos cantan mientras flotan en agua poco profunda, donde se congregan en coros. El amplexus y la oviposición ocurren en los mismos sitios donde cantan los machos. Según Toft y Duellman (10), la especie presenta el Modo reproductivo 5 (11), con huevos depositados en nidos de espuma sobre o cerca del agua y con renacuajos que se desarrollan en el agua. La pareja amplectante construye nidos de espuma hemisféricos (que contienen alrededor de 300 huevos no pigmentados), los cuales se forman mientras el macho bate los huevos con sus patas traseras (8). Los nidos pueden ser construidos también bajo hojas secas de Cecropia sp. que flotan sobre agua poco profunda (D. A. Ortiz obs. pers.). Una hembra grávida contenía 340 huevos (9). Padilla (2) encontró que ninguno de los factores ambientales examinados estaban correlacionados con la actividad reproductiva. Engystomops petersi se reproduce simultáneamente con el hílido simpátrico Dendropsophus rhodopeplus, pero los factores ambientales afectando a ambas especies no son claros (2).
Distribution
En Ecuador, se distribuye ampliamente en las estribaciones orientales de los Andes, desde la provincia de Sucumbíos hasta Morona Santiago (15).
Global Distribution
Altitudinal Range
De 89 a 1200 metros sobre el nivel del mar (24).
Taxonomy and Evolutionary Relationships
Dentro del género Engystomops, en base a datos moleculares. Engystomops petersi fue asignada al clado Edentulus (sensu Ron et al. ( 3)), que incluye también a Engystomops pustulosus, Engystomops freibergi y tres especies no descritas (candidatas confirmadas) ( 3, 25, 26). El clado hermano de Engystomops petersi contiene a estas tres especies nuevas según la filogenia molecular (genes mitocondriales) de Funk et al. ( 25). Funk et al. ( 16) proveen evidencia molecular que indica la existencia de tres linajes bien definidos que podrían ser especies distintas: uno en el drenaje superior del río Napo en Ecuador y Perú adyacente, otro en los drenajes de los ríos Juruá y Madre de Díos en Perú y Brasil adyacente, y un tercero del Estado de Pará, Brasil. En otro estudio similar, en base a información morfológica, acústica y molecular, Funk et al. ( 25) reportan una gran diversidad críptica dentro de Engystomops petersi, sugiriendo la existencia de tres nuevas especies candidatas confirmadas (ECC) y dos especies candidatas no confirmadas (ECNC). Las tres especies candidatas confirmadas se encuentran en Ecuador ( 25). En la filogenia de Jetz y Pyron ( 27) Engystomops petersi es especie hermana de Engystomops freibergi.
Additional Information
Wassersug y Heyer (28) describen la morfología de la cavidad oral del renacuajo. Gascon et al. (29) encontraron alta diversidad genética interpoblacional a lo largo del Río Juruá, Amazonía brasileña, sugiriendo cierto grado de diferenciación. Sin embargo, al probar la hipótesis del Río Juruá como barrera biogeográfica al flujo génico, encontraron poco soporte debido a que ambos lados del río mostraron similitud genética para esta especie (29). Lescure y Marty (14) proveen una foto y un sumario perteneciente a la Guayana Francesa. Duellman (9), Ron et al. (6) y Funk et al. (17) proveen fotografías en vida de individuos de Ecuador. Valencia et al. (7) la incluyen en su guía de campo. Funk et al. (17) describen el canto de anuncio en detalle y proveen un oscilograma y un audioespectrograma. Indican también que además del prefijo y el “whine” característicos del canto, algunos individuos de poblaciones de Ecuador pueden adherir facultativamente otro componente: “squawk”, el cual se cree es análogo y puede ser homologo al “chuck” de Engystomops pustulosus (17). Aunque no incluyen a Engystomops petersi en su estudio, Ron et al. (1) comentan sobre el uso en sistemática del canto de anuncio en Engystomops. Boul et al. (21), Guerra y Ron (4) y Funk et al. (22) estudiaron la selección sexual en función del canto de anuncio en Engystomops petersi, demostrando que este parámetro cumple un rol importante en la especiación. Ryan y Drewes (20) estudiaron la morfología del aparato vocal y su relación con el canto de anuncio. La citología y citogenética de la especie fueron estudiadas por Lourenço et al. (18, 19). Trillo et al. (30) proveen información acerca de patrones de apareamiento e hibridación de tres especies del complejo Engystomops petersi.



Summary Author
Diego A. Ortiz, Morley Read y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2013-07-31T00:00:00
Update Date
2022-09-26T18:38:11.627
Literature Cited
Ron, S. R., Coloma, L. A. y Cannatella, D. C. 2005. A new cryptic species of Physalaemus (Anura: Leptodactylidae) from western Ecuador with commments on the call structure of the P. pustulosus species group. Herpetologica 61:178-198.PDF Padilla, S. 2005. Actividad reproductiva de dos comunidades de anuros en el Parque Nacional Yasuní. Tesis de Licenciatura. Pontificia Universidad Católica del Ecuador. Escuela de Biología. Quito. Ron, S. R., Cannatella, D. C., Santos, J. C. 2006. Phylogeny of the túngara frog genus Engystomops (Physalaemus pustulosus species group; Anura: Leptodactylidae).. Molecular phylogenetics and evolution 39:392-403.PDF Guerra, M. A. y Ron, S. R. 2008. Mate choice and courtship signal differentiation promotes speciation in an amazonian frog. Behavioral Ecology 19:1128-1135.PDF Jiménez de la Espada, M. 1872. Nuevos batracios americanos. Anales de la Sociedad Española de Historia Natural. Madrid 1:85-88. Ron, S. R., Bustamante, M. R., Coloma, L. A. y Mena, B. 2009. Sapos, Ecuador sapodiverso. Serie de Divulgación del Museo de Zoología. Centro de Biodiversidad y Ambiente, Pontificia Universidad Católica del Ecuador 10:256. Valencia, J., Toral, E., Morales, M., Betancourt, R. y Barahona, A. 2009. Guía de campo de anfibios del Ecuador. Fundación Herpetológica Gustavo Orcés, Simbioe. Maxigraf S. A., Quito 208. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Crump, M. 1974. Reproductive strategies in a tropical anuran community. Miscellaneous Publications of the Museum of Natural History. University of Kansas 61:1-68.PDF Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Funk, W. C., Caldwell, J. P., Peden, C. E. y Padial, J. M. 2007. Tests of biogeographic hypotheses for diversification in the Amazonian forest frog, Physalaemus petersi. Molecular Phylogenetics and Evolution 44:825-837. Funk, W. C., Angulo, A., Caldwell, J. P., Ryan, M. J. y Cannatella, D. C. 2008. Comparison of morphology and calls of two cryptic species of Physalaemus (Anura: Leiuperidae). Herpetologica 64:290-304. Lourenco, L. B., Recco-Pimentel, S. M. y Cardoso, A. J. 1998. Polymorphism of the Nucleolus Organizer Regions (NORs) in Physalaemus Petersi (Amphibia, Anura, Leptodactylidae) Detected by Silver Staining and Fluorescence In Situ Hybridization. Chromosome Research 6:621-628. Lourenco, L. B., Recco-Pimentel, S. M. y Cardoso, A. J. 1999. Two karyotypes and heteromorphic sex chromosomes in Physalaemus petersi (Anura,Leptodactylidae). Can. J. Zool 77:624-631. Ryan, M. J. y Drewes, R. C. 1990. Vocal morphology of the Physalaemus pustulosus species group (Leptodactylidae): morphological response to sexual selection for complex calls.. Biological Journal of the Linnean Society .PDF Boul, K. P., Funk, W. C., Darst, C. R., Cannatella, D. C. y Ryan, M. J. 2007. Sexual selection drives speciation in an Amazonian frog. Proceedings of the Royal Society B 274:399-406. Funk, W. C., Cannatella, D. C. y Ryan, M. J. 2009. Genetic divergence is more tightly related to call variation than landscape features in the Amazonian frogs Physalaemus petersi and P. freibergi. J. Evol. Biol 22:1839-1853.PDF Duellman, W. E. y Mendelson III, J. R. 1995. Amphibians and reptiles from northern departamento Loreto, Peru: Taxonomy and biogeography. University of Kansas Science Bulletin, 55:329-376.PDF IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Funk, W. C., Caminer, M., Ron, S. R. 2012. High levels of cryptic species diversity uncovered in Amazonian frogs. Proceedings of the Royal Society of London B 279:1806-1814. doi:10.1098/rspb.2011.1653PDF Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858. Wassersug, R. J. y Heyer, W. R. 1988. A survey of internal oral features of leptodactyloid larvae (Amphibia: Anura). Smithsonian Contributions to Zoology 457:1-99. Gascon, C., Lougheed, S. C., Bogart, J. P. 1998. Patterns of genetic population differentiation in four species of Amazonian frogs: a test of the riverine barrier hypothesis. Biotropica 30:104-119. Trillo, P. A., Narváez, A. E., Ron, S. R., Hoke, K. L. 2017. Mating patterns and post-mating isolation in three cryptic species of the Engystomops petersi species complex. PLoS ONE 12.
|


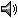


 Map of Life
Map of Life



