|
Vernacular Name
Sapo terrestre amazónico
State/Provinces
Napo, Orellana, Sucumbíos, Morona Santiago
Natural Regions
Bosque Húmedo Tropical Amazónico, Bosque Piemontano Oriental, Bosque Montano Oriental
Identification
Es una rana grande de color café anaranjado o verdoso, con una línea negra que se extiende desde el hocico, pasa por la narina y llega hasta atrás del tímpano y vientre crema. Presenta un cuerpo robusto, liso y los machos tienen dos espinas en el pecho y una en el pulgar. En la Amazonía de Ecuador, Leptodactylus knudseni es similar a otros leptodactílidos grandes que presentan una cabeza relativamente ancha y pliegues dorsolaterales conspicuos: Leptodactylus mystaceus, Leptodactylus rhodomystax, Leptodactylus stenodema y Leptodactylus pentadactylus, y ránidos como Rana palmipes (14). Leptodactylus mystaceus y Leptodactylus rhodomystax tienen líneas supralabiales blancas y anchas (ausentes en Leptodactylus knudseni) (4). Se diferencia de Leptodactylus stenodema en que esta presenta un canto rostral poco definido y carece de una línea negra entre el narina y el ojo (canthus definido y línea presente en Leptodactylus knudseni), de manchas tranversales en el dorso (presentes en Leptodactylus knudseni), y el pliegue dorso-lateral usualmente es delineado de negro, se origina detrás del tímpano y se extiende hasta la ingle (se origina detrás del ojo y se extiende únicamente hasta el sacro en Leptodactylus knudseni) (13, 14, 21).
Leptodactylus knudseni es muy similar a Leptodactylus pentadactylus por la presencia de marcas negras en los labios y marcas transversales en el dorso; sin embargo, esta tiene el vientre obscuro con moteado y vermiculaciones blancas conspicuas (vientre uniformemente blanco u obscuro en Leptodactylus knudseni), pliegues dorsolaterales se extienden hasta la ingle (se extienden únicamente hasta el sacro en Leptodactylus knudseni), espinas cornificadas ausentes en pulgar y pecho en machos reproductivos (espinas conspicuas en pulgares y pecho en Leptodactylus knudseni), pliegue supratimpánico es continuo y se extiende hacia los costados (pliegue se extiende a manera de un punto o verruga alargada en Leptodactylus knudseni), barras verticales obscuras en los labios (triángulos obscuros en Leptodactylus knudseni) (2, 4, 13, 14, 16, 21). Leptodactylus knudseni se diferencia de Rana palmipes debido a que tiene el dorso café anaranjado uniforme o verde pálido con bandas transversales más obscuras y conspicuas que el color de fondo, y membrana interdigital basal entre los dedos del pie (dorso verde grisáceo y membrana extensa entre los dedos del pie en Rana palmipes) (4). Juveniles de Leptodactylus knudseni de poblaciones de Ecuador y Perú presentan inclusive un patrón de coloración amarilla verdosa en la cabeza y dorso, lo cual no ha sido registrado para ninguna otra especie (14, 34).
Description
Leptodactylus knudseni es una especie de tamaño muy grande y cuerpo robusto que presenta la siguiente combinación de caracteres (modificado de Heyer (1); Rodríguez y Duellman (4); Heyer (2); Heyer y Heyer (14); Lima et al. (21)): (1) cabeza tan o inclusive más ancha que larga; (2) piel dorsal lisa; generalmente, un par de pliegues dorsolaterales está presente, los cuales se originan detrás del ojo y se extienden posteriormente hasta el sacro (raramente se extienden más allá del sacro hasta alcanzar la ingle); (3) pliegues del flanco (que son extensiones del pliegue supratimpánico que continua ventralmente) generalmente se encuentran totalmente ausentes o representados únicamente por un punto/verruga obscuro alargado en el área donde el pliegue raramente está presente en algunos especímenes; (4) un pliegue lateral encima del tímpano (que diverge en el mismo punto que el pliegue del flanco) se extiende directamente hasta la ingle y es discernible en algunos individuos bien preservados; (5) en machos sexualmente activos, sacos vocales no visibles externamente o se extienden débilmente como un solo saco; tienen antebrazos hipertrofiados, una gran espina negra en cada pulgar (ocasionalmente los machos más grandes tienen adicionalmente un bulto prepólico pequeño, negro y queratinizado), y un par de grandes espinas negras en el pecho; (6) extremidades posteriores moderadamente largas; la pantorrilla superior y las superficies tarsales externas generalmente llevan de algunos a varios tubérculos negros o blancos dispersos; (7) puntas de dedos de pies redondeadas, son igual de anchas o apenas ligeramente más anchas que las falanges adyacentes; dedos del pie inclusive presentan rebordes cutáneos débiles y membrana basal; especímenes metamórficos o ligeramente más grandes, carecen de rebordes cutáneos o membranas entre los dedos del pie; (8) planta del pie generalmente lisa, aunque en algunos especímenes es áspera y tiene tubérculos blancos;
Color in Life
Modificado de Heyer (1), Rodríguez y Duellman (3), Heyer (2), Heyer y Heyer (14), Lima et al. (21): (1) labio superior carece de una línea clara distinta y generalmente tiene una serie de marcas triangulares obscuras, una o dos que son alargadas y se acercan o alcanzan el párpado inferior; línea negra se extiende desde las narinas, pasa por los ojos y se extiende hacia atrás, contorneando el pliegue supratimpánico que se dirige ventralmente; pliegue dorsolateral puede o no ser contorneado de café obscuro; (2) dorso café anaranjado uniforme claro u obscuro o verde pálido, generalmente lleva una serie de dos o más bandas transversales o chevrones más obscuros contorneados de negro y una banda o chevrón interorbital; superficie dorsal de tibia con barras distintas o indistintas; línea dorsal media ausente; (3) en algunas poblaciones de Ecuador y Perú, los juveniles tienen coloración dorsal en la cabeza amarilla verdosa con muslos sólidamente negros; los individuos recién metamorfos inclusive son cenizos uniformemente; (4) vientre uniforme claro, uniforme obscuro, con pequeños puntos claros o vermiculaciones; superficie posterior del muslo es uniformemente obscura, generalmente con vermiculaciones o puntos pequeños a grandes; (5) iris bronce dorsalmente, anaranjado ventralmente.
Males Face Cloacal Length Average
Promedio = 131.4 mm (rango 94.0–170.0; n = 78) (2
Females Face Cloacal Length Average
Promedio = 132.0 mm (rango 102.7–154.0; n = 37) (2
Habitat and Biology
Leptodactylus knudseni es una especie nocturna y terrestre que habita en bosque de tierra firme y áreas más abiertas en la Amazonía (2, 3, 21). En la Amazonía norte, Ribeiro et al. (32) reportaron que la especie fue encontrada con mayor frecuencia en zonas no riparias (alejadas de cursos de agua), aunque también fue encontrada en zonas riparias pero en menor frecuencia. En el Cuzco amazónico, Perú, la especie fue extremadamente rara con apenas un individuo encontrado en la mitad de la época lluviosa (7). El canto de anuncio consiste en un “who-ep”, el cual es emitido por los machos desde el borde de cuerpos de agua aislados dentro del bosque (3, 21) o en el borde de charcas adyacentes a riachuelos (16). En la Amazonía central, machos vocalizaron durante todo el año pero los nidos de espuma fueron encontrados con mayor frecuencia entre octubre y marzo (21). Gascon (15) reportó también que Leptodactylus knudseni vocaliza a lo largo del año, pero la época de anidación corresponde a períodos de alta precipitación. Previo al cortejo, el macho escarba un agujero en depresiones cercanas pero no directamente conectadas a las pozas de agua, donde la pareja deposita un nido de espuma (21). El nido de espuma contiene aproximadamente 1000 huevos (21) y puede alcanzar un volumen de 2 litros (15). Los huevos eclosionan y los renacuajos se desarrollan dentro del nido, llegando alcanzar una longitud de 69 mm (3).
Las lluvias eventuales inundan el agujero y los renacuajos migran hacia las pozas de agua donde completan su desarrollo (3, 16, 21, 27). En la Amazonía Central, renacuajos han sido encontrados únicamente en pozas aisladas dentro del bosque (> 150 m de un riachuelo), pero nunca en pozas a lado de riachuelos (< 150 m) (30). Los renacuajos son elongados y explotan una amplia variedad de recursos, llegando a ser carnívoros facultativos (14). Se ha reportado que las larvas de Leptodactylus knudseni se alimentan de huevos conespecíficos, e inclusive de otros anuros (3, 16, 21). Cuando la poza se seca, los renacuajos pueden sobrevivir por algunos días o semanas inclusive, congregándose en depresiones con lodo, hasta que la poza se inunde nuevamente (21). La depredación sobre nidos es muy baja (5% de los nidos estudiados) y en todos los casos fueron atacados por una larva de mosca del género Gastrops (15). Azevedo-Ramos et al. (31) indican que renacuajos de Leptodactylus knudseni fueron encontrados únicamente en pozas temporales en una sabana en la Amazonía central, y que la predación (principalmente por peces) sería el factor más importante en determinar la composición de comunidades de renacuajos de anuros en esta área. Leptodactylus knudseni se encuentra en las mismas áreas generales que Leptodactylus labyrinthicus, Leptodactylus myersi, Leptodactylus paraensis y Leptodactylus pentadactylus (2). Leptodactylus knudseni exhibe un amplio solapamiento de nicho con Leptodactylus mystaceus y Leptodactylus wagneri; mientras que el sopamiento de nicho fue moderado con Leptodactylus pentadactylus (22).
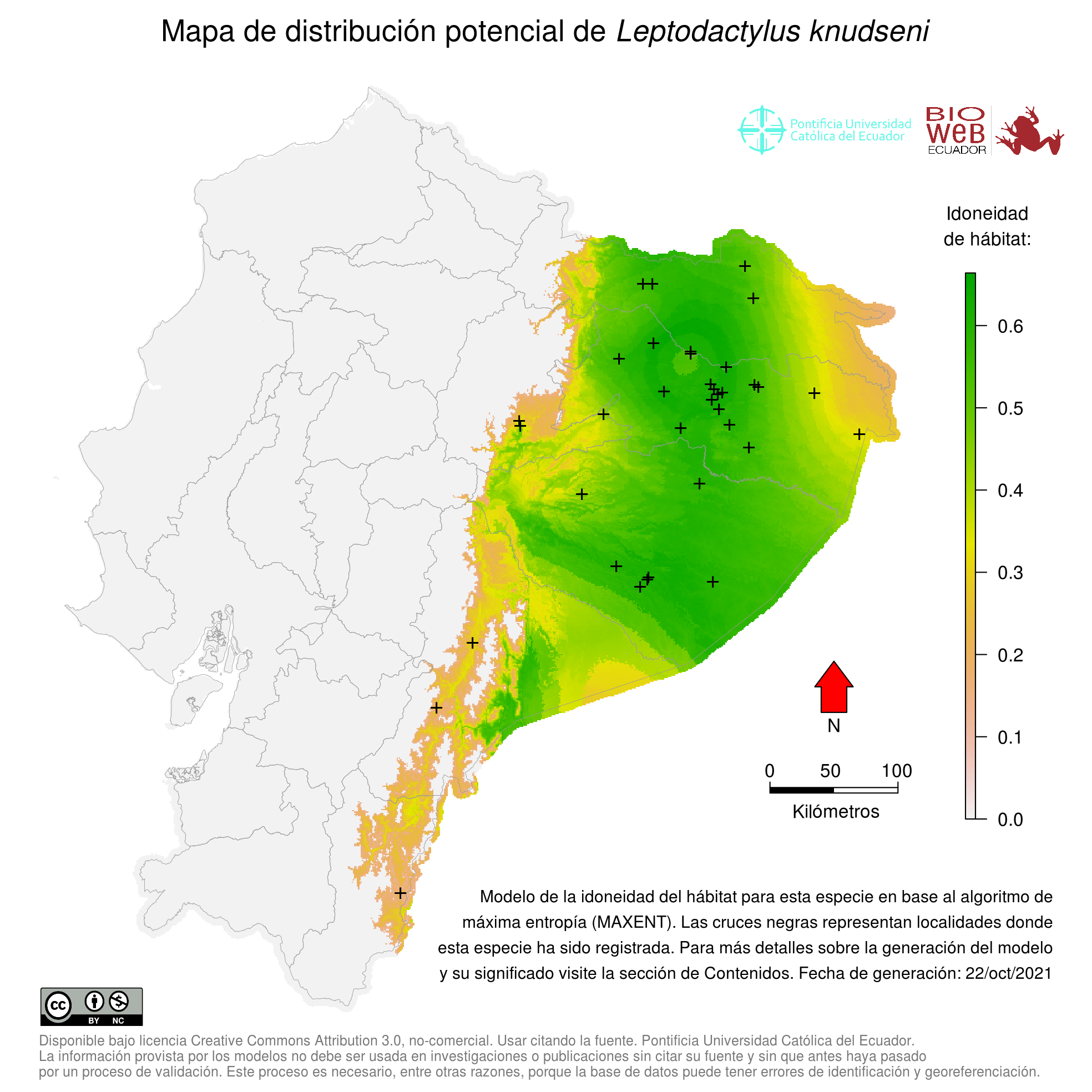
Distribution
Leptodactylus knudseni se distribuye ampliamente en la Cuenca Amazónica de Ecuador, Perú, Bolivia, Brasil, y hacia el norte hasta Colombia, Venezuela, Guyana, Guayana Francesa, Suriname y Trinidad (2, 6, 13, 21, 25, 34). Sin embargo, la distribución predicha con modelamiento de nicho indicó que Leptodactylus knudseni podría presentar una distribución heterogénea a través de su rango geográfico, ya que existen extensas áreas en la Amazonía no apropiadas para la presencia de la especie (19).
Altitudinal Range
De 0 a 1800 m sobre el nivel del mar (25).
Taxonomy and Evolutionary Relationships
Está cercanamente relacionado a un clado formado por Leptodactylus savagei y Leptodactylus pentadactylus ( 12, 26, 34, 35). Forma parte del grupo de especies Leptodactylus pentadactylus ( 1, 13, 34, 35).
Etymology
El nombre específico knudseni es un patronímico en dedicación a Jens W. Knudsen, quien fomentó en el autor el entusiasmo por la investigación biológica y apoyó continuamente sus estudios (1, 34).
Additional Information
Heyer (2) presenta una descripción detallada de Leptodactylus knudseni en la que analiza la morfología de adultos y juveniles y el canto de anuncio para várias localidades a través de su rango de distribución, y concluye que a pesar de la existencia de diferencias entre las poblaciones analizadas, esta variación es conespecífica y Leptodactylus knudseni representa una sola especie con amplia distribución. Usando datos moleculares y de canto de anuncio, Heyer et al. (2005) identificaron las relaciones dentro del grupo pentadactylus. Sin embargo, contrario a lo esperado, las especies dentro del grupo presentaron una alta similitud morfológica y de cantos de anuncio. Por ejemplo, el canto de Leptodactylus knudseni no puede ser distinguido diferencialmente del de Leptodactylus savagei. Estos resultados indican que el rol de los cantos de anuncio en el proceso de especiación de este grupo de anuros requiere de evaluación. Al parecer, la morfología larval y características de hábitat podrían ser más importantes en los procesos de especiación (2).
Heyer (1) describe la especie e indica que su cariotipo es 2N = 22, con 3 pares de cromosomas medios, 4 pares de submedios y 4 pares de subterminales, sin presentar constricciones secundarias. Presenta también una clave de identificación para el grupo pentadactylus, así como fotografías en vista dorsal y ventral de un paratipo, y del hábitat de colección de la serie tipo en Limoncocha, Ecuador (1). Duellman (4) presenta la fotografía de un juvenil de Lepodactylus knudseni (erróneamente ubicado bajo Leptodactylus pentadactylus). En efecto, este relato de Santa Cecilia, Ecuador (4) es ambiguo ya que podría referirse a Leptodactylus pentadactylus, Leptodactylus knudseni, o ambas. Adicionalmente, el renacuajo descrito en este mismo estudio como Leptodactylus pentadactylus (4), en realidad corresponde a Leptodactylus knudseni (14). Heyer (13) proporciona una lista de caracteres y una clave dicotómica de identificación para adultos del grupo pentadactylus, e ilustra también los diferentes patrones de coloración del dorso, cabeza y extremidades posteriores dentro del grupo. Presenta también una descripción del canto de anuncio acompañada de un audioespectrograma y un oscilograma de Leptodactylus knudseni (13). Wassersug y Heyer (28) describen la morfología de la cavidad oral del renacuajo. Hero y Galatti (16) presentan información sobre ecológica reproductiva, un audioespectrograma del canto de anuncio, y describen diferencias morfológicas con Leptodactylus pentadactylus. Hero (27) describe el renacuajo, provee información ecológica del mismo, y una clave de identificación con renacuajos de otras especies para la Amazonía Central, Brasil. Hero y Galatti (16) presentan información ecológica y un audioespectrograma para diferenciarla de Leptodactylus pentadactylus.
Rodríguez y Duellman (3) presentan un escrito y una fotografía de especímenes de "Iquitos", Perú. Murphy (6) proporcionó un relato sobre "Trinidad". Gorzula y Señaris (5) comentan sobre su distribución en Venezuela, e indican que la descripción original fue basada en un juvenil que no presentaba el patrón típico de coloración del adulto. Lescure y Marty (8) proporcionaron una foto y un escrito de especímenes de la Guayana Francesa. Heyer (2) provee una revisión detallada de la especie, acompañada de oscilogramas y espectrogramas del canto de anuncio. Su frecuencia dominante es de 340-690 Hz. La duración del canto es de 0.16-0.43 s con 6-14 pulsos por segundo. Estructura armónica bien desarrollada. Heyer et al. (18) presenta una hipótesis filogenética del grupo pentadactylus y presentan un oscilograma y un audioespectrograma del canto de Leptodactylus knudseni. Heyer y Heyer (14) proveen una revisión detallada de la especie, una fotografía en vida, la descripción del canto de anuncio (acompañada de un oscilograma y audioespectrograma) y del renacuajo (acompañada de ilustraciones en vista lateral y del disco oral). También presentan una extensa lista de referencias literarias pertinentes a la especie (14). Lima et al. (21) proveen fotografías en vista dorsolateral y ventral de un macho, de las superficies ocultas de muslos, de una pareja en amplexus construyendo un nido de espuma y de un juvenil, de especímenes de la Amazonía Central, Brasil. Ernst et al. (17) evaluaron los impactos de la tala selectiva de árboles sobre la distribución, desarrollo larval y supervivencia de tres especies de Leptodactylus simpátricos que construyen nidos de espuma (incluyendo Leptodactylus knudseni) en una selva tropical en Guyana. Kok y Kalamandeen (9) proporcionan un relato y la incluyen en su clave de identificación de Leptodactylus de Guyana; también sugiren que este taxón podría ser un complejo de especies debido a su amplia distribución y variación en coloración, especialmente en juveniles. Utilizando datos de presencia, Fernández et al. (19) modelaron la distribución de la especie y proporcionan mapas. Ouboter y Jairam (29) comentan sobre su distribución en Surinam. Maxson y Heyer (24) realizan un análisis bioquímico de albúminas para varias especies de Leptodactylus, dando soporte a la distinción de los grupos de especies pentadactylus y melanonotus; y sugieren también que la mayor diversificación en Leptodactylus ocurrió durante el Paleoceno (65.5–55.5 millones de años). Heyer (33) propone una representación diagramática de las relaciones entre grupos de especies dentro de Leptodactylus e indican que el grupo pentadactylus estaría más cercanamente relacionado con los grupos melanonotus más ocellatus. Heyer (33) y Prado et al. (20) postularon que Leptodactylus y Adenomera constituyen un grupo que ha experimentado transición desde el medio acuático hacia el terrestre, y que la gran diversidad de los sitios de oviposición de nidos de espuma entre especies abarca un amplio rango de esta transición. Siguiendo este razonamiento, los grupos de especies desde el más primitivo al más derivado son: melanonotus más ocellatus (nido en la superficie del agua), pentadactylus (nidos en cavidades adyacentes al agua), fuscus (nidos en cámaras de incubación y larva acuática), y Adenomera (nidos en cámaras de incubación y larva no acuática). También existe una relación en reducir el tamaño de la puesta y aumentar el diámetro de los huevos conforme un grupo es más terrestre (33). Bogart (11) y Amaro-Ghilardi et al. (23) sugieren que la condición de 26 cromosomas es primitiva en Leptodactylus, y que los linajes más derivados experimentaron una reducción a 22 o 24 cromosomas; sin embargo, Heyer y Diment (10) indican que el uso de cariotipos en develar las relaciones filogenéticas en Leptodactylidae es de uso limitado, y tiene que ser usado en combinación con otros sets de datos.



Summary Author
Diego A. Ortiz, Morley Read, Andrea Varela-Jaramillo y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2013-09-13T00:00:00
Update Date
2022-09-26T18:48:32.973
Literature Cited
Heyer, W. R. 1972. The status of Leptodactylus pumilio Boulenger (Amphibia, Leptodactylidae) and the description of a new species of Leptodactylus from Ecuador. Contributions in Science 231:1-8.PDF Heyer, W. R. 2005. Variation and taxonomic clarification of the large species of the Leptodactylus pentadactylus species group (Amphibia: Leptodactylidae) from Middle America, northern southamerica, and Amazonia. Arquivos de Zoologia 37:269-348.PDF Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Gorzula, S. y Señaris, S. 1998. Contribution to the herpetofauna of the Venezuelan Guayana I. A database. Scientiae Guaianae 8:1-270. Murphy, J. C. 1997. Amphibians and reptiles of Trinidad and Tobago. Krieger Publishing Company. Malabar, Florida. xiii+245. Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Kok, P. y Kalamandeen, M. 2008. Introduction to the Taxonomy of the Amphibians of Kaieteur National Park, Guyana. Abc Taxa: A Series of Manual Dedicated to Capacity Building in Taxonomy and Collection Management, Brussels, Belgium, Belgian Development Corporation 1-288. Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Ponssa, M. L. 2008. Cladistic analysis and osteological descriptions of the frog species in the Leptodactylus fuscus species group (Anura, Leptodactylidae). J Zool Syst Evol Res 46:249-266.PDF Heyer, W. R. 1979. Systematics of the pentadactylus species group of the frog genus Leptodactylus (Amphibia: Leptodactylidae). Smithsonian Contributions to Zoology 301:1-43.PDF Heyer, W. R. y Heyer, M. M. 2006. Leptodactylus knudseni. Catalogue of American Amphibians and Reptiles 807:1-12.PDF Gascon, C. 1991. Breeding of Leptodactylus knudseni: Responses to Rainfall Variation. Copeia 1991:248-252.PDF Hero, J. M. y Galatti, U. 1990. Characteristics Distinguishing Leptodactylus pentadactylus and L. knudseni in the Central Amazon Rainforest. Journal of Herpetology 24:226-228.PDF Ernst, R., Konrad, T., Linsenmair, K. E. y Rödel, M. M. 2007. The impacts of selective logging on three sympatric species of Leptodactylus in a Central Guyana rainforest.. 28:51-64. Heyer, W. R., de Sá, R. y Rettig, N. 2005. Sibling Species, advertisment calls, and reproductive isolation in frogs of the Leptodactylus pentadactylus species cluster (Amphibia: Leptodactylidae). Herpetologia Petropolitana, Ananjeva N. and Tsinenko O. (eds.) 2005:35 – 39.PDF Fernández, M., Cole, D., Heyer, W. R., Reichle, S. y de Sá, R. 2009. Predicting Leptodactylus (Amphibia, Anura, Leptodactylidae) Distributions: Broad-Ranging Versus Patchily Distributed Species Using a Presence-Only Environmental Niche Modelling Techniques. South American Journal of Herpetology 4:103-116.Enlace Prado, C. P. A., Uetanabaro, M., Haddad, C. F. B. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae) with a review on the reproductive specialization toward terrestriality in the genus. Copeia 2002:1128-1133.PDF Lima, A. P., Magnusson, W. E., Menin, M., Erdtmann, L., Rodrigues, D. J., Keller, C., Hödl, W. 2006. Guia de sapos da Reserva Adolpho Ducke, Amazônia Central = Guide to the frogs to Reserva Adolpho Ducke, Central Amazonia. Átemma, Manaus. 168 p. Heyer, W. R. y Bellin, M. S. 1973. Ecological Notes on Five Sympatric Leptodactylus (Amphibia, Leptodactylidae) from Ecuador. Herpetologica 29:66-72.PDF Amaro-Ghilardi, R. C., Skuk, G., de Sá, R., Rodrígues, M. T. y Yonenaga-Yassuda, Y. 2006. Karyotypes of eight species of Leptodactylus (Anura, Leptodactylidae) with a description of a new karyotype for the genus. Phyllomedusa 5:119-133. Maxson, L. R. y Heyer, W. R. 1988. Molecular systematics of the frogs genus Leptodactylus (Amphibia: Leptodactylidae). Fieldiana, Zoology, New Series 41:1-13. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Hero, J. M. 1990. An illustrated key to tadpoles occurring in the central Amazon rainforest, Manaus, Amazonas, Brasil. Amazoniana 11:201-262. Wassersug, R. J. y Heyer, W. R. 1988. A survey of internal oral features of leptodactyloid larvae (Amphibia: Anura). Smithsonian Contributions to Zoology 457:1-99. Ouboter, P. E. y Jairam, R. 2012. Amphibians of Suriname. Brill. 388 pp. Rodrigues, D. J., Lima, A. P., Magnusson, W. E., Costa, F. R. C. 2010. Temporary Pond Availability and Tadpole Species Composition in Central Amazonia. Herpetologica 66:124-130. Azevedo-Ramos, C., Magnusson, W. E., Bayliss, P. 1999. Predation as the key factor structuring tadpole assemblages in a savanna area in Central Amazonia. Copeia 1999:22-23. Ribeiro, J. W., Lima, A. P., Magnusson, W. E. 2012. The effect of riparian zones on species diversity of frogs in Amazonian forests. Copeia 2012:375-381. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF de Sá, R., Grant, T., Camargo, A., Heyer, W. R., Ponssa, M. L., Stanley, E. 2014. Systematics of the neotropical genus Leptodactylus Fitzinger, 1826 (Anura: Leptodactylidae): phylogeny, the relevance of non-molecular evidence, and species accounts. South American Journal of Herpetology 9:S1-S128. Gazoni, T., Lyra, M., Ron, S., Strüssmann, C., Baldo, D., Narimatsu, H., Pansonato, A., Schneider, R., Giaretta, A., Haddad, C., Parise-Maltempi, P., de Carvalho, T. 2021. Revisiting the systematics of the Leptodactylus melanonotus group (Anura: Leptodactylidae): Redescription of L. petersii and revalidation of its junior synonyms. Zoologischer Anzeiger 290: 117—134.
|





 Map of Life
Map of Life



