|
Vernacular Name
Sapo-rana terrestre común
State/Provinces
Napo, Orellana, Pastaza, Sucumbíos, Morona Santiago
Natural Regions
Bosque Húmedo Tropical Amazónico, Bosque Piemontano Oriental
Identification
Es una rana mediana de color café, con una máscara oscura que se extiende desde el hocico hasta detrás del párpado, una línea supralabial crema y vientre amarillo o crema. Presenta dos pliegues dorsolaterales prominentes, un hocico acuminado y rebordes cutáneos en los dedos ausentes. Leptodactylus rhodomystax tiene también una línea supralabial pálida; sin embargo, en su parte anterior esta línea es más ancha, tiene el borde irregular y presenta una coloración café clara rosácea (línea delgada uniformemente y de coloración crema en Leptodactlyus mystaceus). Además, Leptodactylus rhodomystax tiene un hocico romo (punteagudo en Leptodactylus mystaceus), un vientre más obscuro (blanco cremoso en Leptodactylus mystaceus) (3, 4), y la superficie posterior del muslo es negra con numerosas manchas diminutas y redondeadas de color amarillo verdoso o crema (únicamente una línea longitudinal crema está presente en Leptodactylus mystaceus) (17). Leptodactylus mystaceus se diferencia de Leptodactylus discodactylus y Leptodactylus wagneri por la ausencia de rebordes cutáneos en los dedos de los pies (presentes en estas dos últimas especies) (4). Leptodactylus mystaceus tiene pliegues cutáneos dorsolaterales completos, una característica compartida con Leptodactylus pentadactylus, Leptodactylus rhodomystax y con Rana palmipes. La línea supralabial y el vientre blanco cremoso permiten diferenciar a Leptodactylus mystaceus de todas estas ranas, y la presencia de membrana basal entre los dedos del pie sirven para diferenciarla de Rana palmipes, que presenta membrana extensa (4). Leptodactylus mystaceus es muy similar a Leptodactylus didymus de la Amazonía sur y a Leptodactylus notoaktites del sureste de Brasil. Puede ser diferenciada de Leptodactylus didymus únicamente por su canto de anuncio (20) y de Leptodactylus notoaktites por la presencia de tubérculos supernumerarios blancos y dispersos en la planta del pie (no presentes en Leptodactylus notoaktites) (23). Adicionalmente, Leptodactylus mystaceus es frecuentemente confundida con ranas del género Pristimantis, sin embargo, ninguna especie de Pristimantis en la Amazonía de Ecuador tiene una línea labial pálida y pliegues dorsolaterales (4).
Description
Leptodactylus mystaceus es una rana de tamaño medio a grande y cuerpo robusto que pertenece al grupo fuscus como fue definido por Heyer ( 15) y presenta la siguiente combinación de caracteres (modificado de Rodríguez y Duellman ( 3), Duellman ( 4), Heyer ( 15), Lima et al. ( 17), Toledo et al. ( 23): (1) hocico redondeado en vista dorsal y acuminado en vista lateral; (2) piel del dorso lisa y existen dos pliegues dorsolaterales prominentes; (3) dedos de mano carecen de membrana; dedos del pie tienen membrana basal; rebordes cutáneos ausentes en dedos de manos y pies; (4) tubérculos subarticulares y supernumerarios redondeados y conspicuos en manos y pies; (5) machos reproductivos carecen de almohadillas nupciales y de espinas cornificadas en pulgares; (6) superficie posterior del tarso lisa;
Color in Life
Modificado de Rodríguez y Duellman ( 3), Duellman ( 4), Heyer ( 15), Lima et al. ( 17), Toledo et al. ( 23): (1) máscara café obscura o negra se extiende desde la narina, pasa por el ojo y alcanza la parte posterior del tímpano; bajo esta máscara existe una línea supralabial conspicua de color crema que se extiende a lo largo de todo el labio, pasa por debajo del tímpano y alcanza la base del brazo; (2) dorso gris, café claro oliva o café claro rojizo con manchas transversales irregulares cafés obscuras o cafés grisáceas bordeadas por una delgada línea clara; (3) pliegue dorsolateral delineado externamente por café obscuro o negro a lo largo de toda su longitud, e internamente por una línea crema desde la mitad del pliegue hasta la ingle; (4) flancos grises pálidos a cafés claros; (5) antebrazos más pálidos que el dorso y generalmente tienen barras transversales débiles; (6) extremidades posteriores presentan la misma coloración que el dorso y tienen barras transversales obscuras; (7) superficie posterior de muslos moteada con café y negro, y se encuentra atravesada por una línea longitudinal crema en su parte distal; (8) tubérculos del pie blancos; (9) vientre amarillento en machos reproductivos y banco cremoso en hembras y machos no reproductivos; pequeñas manchas cafés están presentes lateralmente en vientre y garganta; (10) iris bronce dorsalmente y café rojizo metálico obscuro ventralmente; (11) ausencia de dimorfismo sexual.
Males Face Cloacal Length Average
promedio = 47.4 mm (rango 42.4–52.2; n = 69) (20
Females Face Cloacal Length Average
promedio = 50.0 mm (rango 44.8–56.1; n = 60) (20
Habitat and Biology
Leptodactylus mystaceus es una especie terrestre y nocturna que se encuentra en bosque secundario, claros, pastizales, borde de bosque, y menos frecuentemente en bosque primario (3, 4), por lo que es considerada una especie generalista y con gran capacidad de adaptación a hábitats alterados por el hombre (24, 26). En la Amazonía norte, Brasil, Ribeiro et al. (32) encontraron que la especie se encuentra igualmente distribuída en zonas riparias (cercanas a cursos de agua) como en zonas no riparias. En el Cuzco amazónico, Perú, la especie fue frecuente tanto al inicio y mitad de la época lluviosa, pero totalmente ausente en época seca (8). Durante el día, las ranas son encontradas bajo troncos u hojarasca; mientras que durante la noche se encuentran en claros o en el suelo del bosque, aunque unos pocos individuos también han sido encontrados en arbustos bajos (< 1.5 m) y en el agua dentro de pantanos (4). Se han escuchado machos vocalizando durante todo el año en Ecuador (4); sin embargo, el grueso de la reproducción y puesta de huevos parecen estar asociadas fuertemente con la época de lluvias (17, 23). Después de fuertes lluvias, los machos vocalizan desde agujeros en el suelo o debajo de troncos, raíces, hojas y pequeños arbustos, en el margen de pequeñas pozas temporales que se encuentran en áreas abiertas o borde de bosque (2, 4, 17, 21, 23, 24). Esta especie también construye galerías subterráneas con múltiples conexiones, que les permiten a los individuos a moverse 1 cm abajo del suelo, lo cual puede proveer protección contra predadores (23). Los machos cantan todas las noches durante la época reproductiva, y esta actividad comienza una hora antes del anochecer; las vocalizaciones aumentan con la disminución de luz ambiental y persisten hasta media noche (23, 24). Leptodactylus mystaceus emplea una técnica que consiste en emitir cantos fuertes para atraer a las hembras desde largas distancias (24). El canto consiste en una serie de notas cortas: “oit-oit-oit”, las cuales son emitidas a una tasa de 48 notas por minuto (3), con intervalos de silencio entre cada serie de notas (24). Al parecer, los machos no muestran asociación en coros para vocalizar (24), aunque coros de esta especie han sido escuchados al lado de una carretera en el Parque Nacional Yasuní, Ecuador (Morley Read notas de campo). La pareja en amplexus construye un nido de espuma, el cual es depositado en una pequeña cuenca en el lodo, la cual es escarbada previamente por el macho bajo troncos en descomposición y raíces. Los nidos son construidos cerca de las pozas temporales y son susceptibles a inundación con las lluvias subsecuentes (17, 21). Los nidos de espuma y las cavidades donde se encuentran llegan a medir 10 cm de diámetro por 5 cm de profundidad (3). Se han encontrado también nidos flotando entre la maleza en agua poco profunda (3, 4).
Las puestas son relativamente pequeñas conteniendo entre 77–300 huevos no pigmentados de tamaño grande: 2.5 mm de diámetro (3, 17, 24). En nidos donde los huevos ya habían eclosionado se contabilizaron entre 233–246 larvas que se encontraban en Estadíos Gosner (30) 18–27. Hembras grávidas contuvieron entre 171–425 huevos ováricos maduros amarillentos de 2.0–2.4 mm de diámetro (4, 23, 24). Los renacuajos son capaces de producir espuma adicional para el nido, lo cual les permite evitar la desecación durante periodos extensos de sequía en el nido terrestre (17, 21). El agua de las eventuales lluvias inunda la cámara del nido y transporta a los renacuajos hacia las pozas de agua adyacentes donde completan su desarrollo (Lima et al. 2006). Mientras están aislados en el nido de espuma, los renacuajos no crecen, almacenando su energía para el crecimiento y metamorfosis en las pozas (21). Dado que los nidos son depositados desde el inicio de la época de lluvias y los renacuajos ya eclosionan en los nidos terrestres, estos pueden tener ventajas de competición y predación sobre renacuajos de otras especies una vez que migran hacia las pozas de agua léntica (21). De este modo, los renacuajos de Leptodactylus mystaceus han sido encontrados en pozas superficiales (< 25 cm de profundidad) con abundante maleza en claros de bosque, en un pantano de Heliconia sp. dentro del bosque, y en una poza parcialmente sombreada en el borde del bosque (4). Los renacuajos se refugian entre las hierbas y las hojas del fondo (4) y llegan alcanzar longitudes de 30 mm, de lo que el 65% corresponde a la cola (3). Los individuos adultos se alimentan mayormente de ortópteros (81% del grueso de la dieta), seguido por escarabajos y otros artrópodos (4). Leptodactylus mystaceus es una especie generalista y se adapta a muchos tipos de hábitats, lo que le confiere un nicho relativamente amplio (24). Dentro del mismo hábitat general (claros en el bosque), los machos de Leptodactylus mystaceus y Leptodactylus wagneri cantan desde diferentes microhábitats por lo que son consideradas especies alotópicas (diferente microhábitat) (24). Por otro lado, la especie ha sido ha sido registrada como sintópica (mismo microhábitat) pues tiene un amplio solapamiento de nicho con Leptodactylus fuscus, Leptodactylus mystacinus (23), y con Leptodactylus wagneri y Leptodactylus knudseni (24). Leptodactylus mystacinus tiene solapamiento de nicho moderado con Leptodactylus pentadactylus (24).
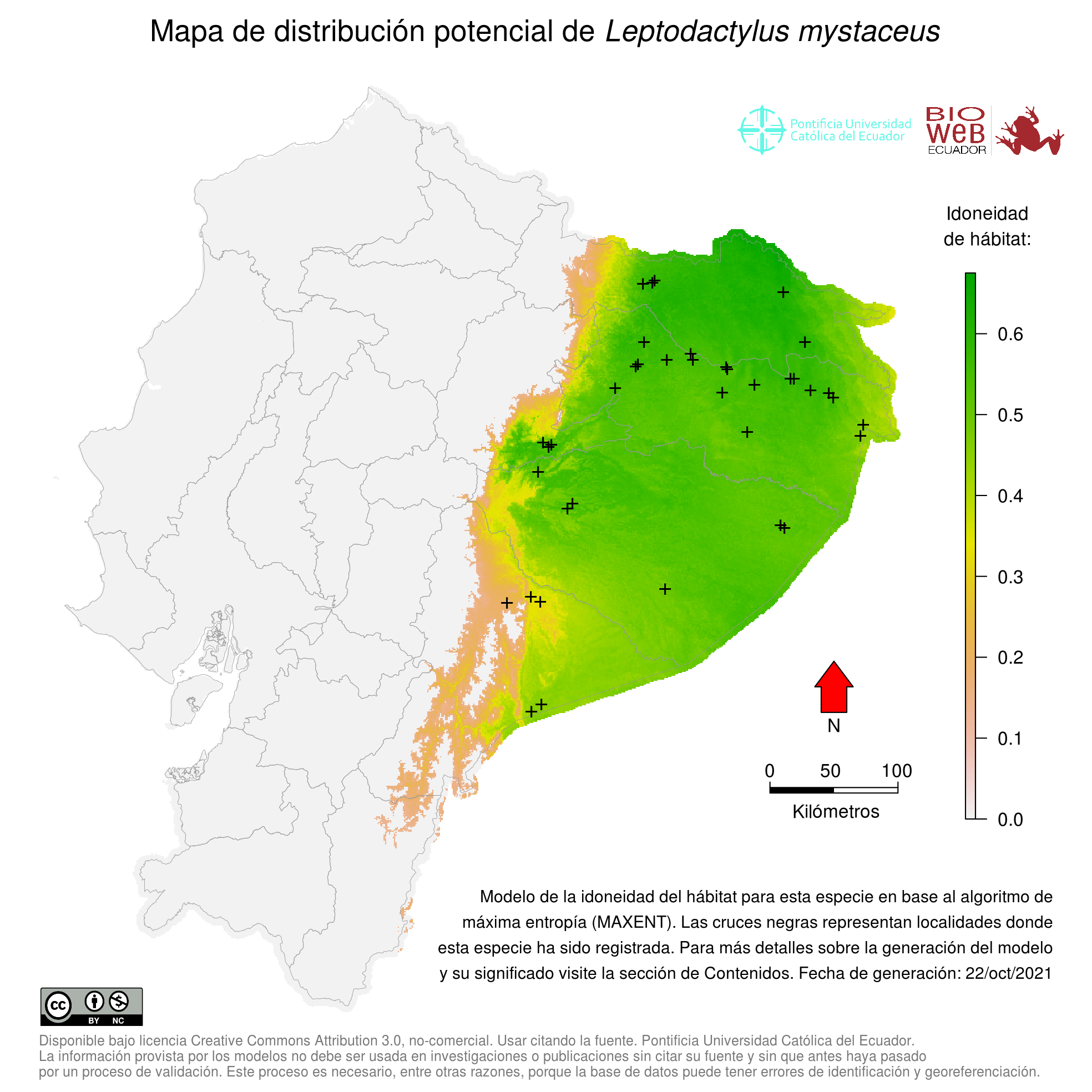
Distribution
Leptodactylus mystaceus tiene una amplia distribución desde el sur de la Cuenca amazónica en Brasil hacia el norte hasta Bolivia, Perú, Ecuador, Colombia, Venezuela, Guyana, Surinam y Guyana Francesa (17, 26, 35, 36). Toledo et al. (23) proporcionaron registros del estado de São Paulo, Brasil, extendiendo su rango geográfico por 1300 kms al sureste, estos registros representan el límite meridional de su distribución.
Altitudinal Range
De 0 a 1000 m sobre el nivel del mar (26).
Taxonomy and Evolutionary Relationships
Leptodactylus mystaceus está cercanamente relacionado a Leptodactylus plaumanni (27). Forma parte del grupo de especies Leptodactylus fuscus (22, 35).
Etymology
Su nombre proviene del griego “mystax, mystakos” que significa bigote sobre el labio superior; en referencia a la banda clara encima de su boca (22).
Additional Information
Heyer y Peters (6) la incluyen en su clave de identificación para individuos adultos de Leptodactylus en Ecuador. Bogart (13) indican que el cariotipo 2N = 22 cromosomas consiste en 5 pares de cromosomas metacéntricos, 3 pares submetacéntricos y 3 pares subtelocéntricos. Por otra parte, Heyer y Diment (12) encontraron ciertas diferencias con Bogart (13) en cuanto a la configuración pero no en el número de cromosomas del cariotipo: 2N = 22 (4 pares de cromosomas metacéntricos, 4 pares submetacéntricos y 3 pares subtelocéntricos). Sugieren que las diferencias encontradas probablemente reflejen diferentes interpretaciones del material, por lo que esta información debe ser analizada con precaución (12). Straughan y Heyer (34) describen el canto y reportan variación geográfica del mismo. Bajo el nombre de “Leptodactylus amazonicus” Heyer (4) presenta un escrito de Leptodactylus mystaceus acompañado de una fotografía en vista dorsal; una ilustración en vista lateral del renacuajo y del disco oral, además, un oscilograma y audioespectrograma del canto de anuncio. Su frecuencia dominante es de 700-1400 Hz. La duración del canto es de 0.2 s. Aumento de frecuencia a lo largo del canto. Ausencia de estructura armónica (35). Duellman (4) y Rodríguez y Duellman (3) presentan un escrito y una fotografía en vista dorsolateral de especímenes de Santa Cecilia, Ecuador e Iquitos, Perú, respectivamente. Duellman (4) describe el canto y un renacuajo en Estadío 27 (30). Gorzula y Señaris (7) comentan sobre su distribución en Venezuela. Lescure y Marty (9) proveen una fotografía y un relato de especímenes de la Guayana Francesa. Toledo et al. (23) proveen ilustraciones en vista dorsal y lateral de la cabeza, y en vista ventral de la mano y pie. Presentan también un oscilograma y un audioespectrograma del canto de anuncio de especímenes del Estado de São Paulo, Brasil. Lima et al. (17) presentan fotografías de un macho en vista dorsolateral y ventral, y de una hembra y un juvenil en vista dorsolateral. Kok y Kalamandeen (11) proporcionan un relato y la incluyen en su clave de identificación de Leptodactylus de Guyana. Ponssa (14) describe en detalle la osteología de los miembros del grupo fuscus. Valencia et al. (2) la incluyen en su guía de campo. Ouboter y Jairam (28) proveen un escrito sobre especímenes de Surinám. Ponssa y Vera Candioti (31) estudiaron la variación en el desarrollo de tamaño y forma del cráneo en Leptodactylus mystaceus después de la metamorfosis, y la comparan con otras cuatro especies del grupo fuscus. Spix (1) describe la especie como Rana mystacea en base a la ilustración de dos individuos: uno del Bosque Atlántico del noreste de Brasil y otro del Río Amazonas en la Amazonía Central. Posteriormente, con la revisión de una mayor cantidad de especímenes y evidencia, Heyer (15) determina que los dos individuos usados por Spix (1) en su descripción, corresponden en realidad a dos especies distintas. Consecuentemente, designa el nombre Leptodactylus mystaceus a la especie del noreste de Brasil, mientras que la especie de la Amazonía fue descrita como Leptodactylus amazonicus (15). Sin embargo, en su revisión del grupo fuscus Heyer (15) pasó por el alto el trabajo previo de Méhelÿ (18) en el cual ya se había aclarado que el individuo descrito en Spix (1) del noreste de Brasil correspondía en realidad a Leptodactylus fuscus, mientras que la forma de la Amazonía fue designada como lectotipo del verdadero Leptodactylus mystaceus (18). Hoogmoed y Gruber (5) discutieron la historia de los especímenes tipo. Para solucionar esta confusión, Heyer (19) sinonimiza a Leptodactylus amazonicus bajo Leptodactylus mystaceus, por lo cual el nombre Leptodactylus mystaceus es designado para la especie amazónica. Debido a estos cambios, la especie que aparece en Heyer (15) del noreste de Brasil como Leptodactylus mystaceus queda sin nombre, y para solventar este problema taxonómico fue descrita como Leptodactylus spixi por Heyer (19).
Heyer et al. (20) presenta un análisis de la variación del canto de anuncio (acompañado de oscilogramas y audioespectrogramas) de Leptodactylus mystaceus a través de su rango de distribución en la Amazonía. Se identificaron al menos dos grupos morfológicamente idénticos pero que varían en sus parámetros de canto. En base a la evidencia disponible, las resoluciones taxonómicas fueron designar el nombre Leptodactylus mystaceus a las poblaciones de la Amazonía norte, centro y occidental (incluido aquí Ecuador) que presentan un canto con pulsos; mientras que las poblaciones de la Amazonía sur fueron descritas como una especie distinta que presenta un canto sin pulsos: Leptodactylus didymus (20). Debido a la similitud morfológica entre Leptodactylus mystaceus y Leptodactylus didymus, ha sido sugerido que ambas serían especies hermanas, lo cual concuerda con el análisis cladístico en base a caracteres osteológicos de Ponssa (14) y con la filogenia molecular de Pyron y Wiens (27). En base a información molecular, Jansen et al. (29) reportan la existencia de una especie críptica no descrita bajo el nombre Leptodactylus mystaceus de Bolivia. Brusquetti y Lavilla (10) sugirieren que los registros de Paraguay de esta especie sean considerados como Leptodactylus elenae. Straughan y Heyer (34) reportan la exitencia de variación en el canto de anuncio entre poblaciones de la Amazonía occidental y Argentina. Dado nuestro conocimiento actual de la distribución de Leptodactylus mystaceus, la especie de Argentina no correspondería a Leptodactylus mystaceus; sin ambargo, no es posible determinar si esta pertenece a Leptodactylus elenae u otra especie.
Heyer (33) propone una representación diagramática de las relaciones entre grupos de especies dentro de Leptodactylus e indican que el grupo fuscus es el menos relacionado a los demás grupos; así las relaciones de los grupos serían: fuscus (pentadactylus (melanonotus + ocellatus)). Heyer (33) y Prado et al. (16) postularon que Leptodactylus y Adenomera constituyen un grupo que ha experimentado transición desde el medio acuático hacia el terrestre, y que la gran diversidad de los sitios de oviposición de nidos de espuma entre especies abarca un amplio rango de esta transición. Siguiendo este razonamiento, los grupos de especies desde el más primitivo al más derivado son: melanonotus + ocellatus (nido en la superficie del agua), pentadactylus (nidos en cavidades adyacentes al agua), fuscus (nidos en cámaras de incubación y larva acuática), y Adenomera (nidos en cámaras de incubación y larva no acuática). También existe una relación en reducir el tamaño de la puesta y aumentar el diámetro de los huevos conforme un grupo es más terrestre (33). Bogart (13) y Amaro-Ghilardi et al. (25) sugieren que la condición de 26 cromosomas es primitiva en Leptodactylus, y que los linajes más derivados experimentaron una reducción a 22 o 24 cromosomas; sin embargo, Heyer y Diment (12) indican que el uso de cariotipos en develar las relaciones filogenéticas en Leptodactylidae es de uso limitado, y tiene que ser usado en combinación con otros sets de datos.



Summary Author
Diego A. Ortiz, Morley Read, Andrea-Varela-Jaramillo y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2013-10-03T00:00:00
Update Date
2022-09-26T18:56:11.11
Literature Cited
Spix, J. B. 1824. Animalia nova sive Species novae Testudinum et Ranarum quas in itinere per Brasiliam annis MDCCCXVII-MDCCCXX jussu et auspiciis Maximiliani Josephi I. Bavariae Regis. Typis Franc. Seraph, Hübschmanni, Munich, Germany.PDF Valencia, J., Toral, E., Morales, M., Betancourt, R. y Barahona, A. 2009. Guía de campo de anfibios del Ecuador. Fundación Herpetológica Gustavo Orcés, Simbioe. Maxigraf S. A., Quito 208. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Hoogmoed, M. S. y Gruber, U. 1983. Spix and Wagler type specimens of reptiles and amphibian in the Natural History Museum in Munich (Germany) and Leiden (The Netherlands). Spixiana Supplement 9:319-415. Heyer, W. R. y Peters, J. A. 1971. The frog Genus Leptodactylus in Ecuador. Proceedings of the Biological Society of Washington 84:163-170. Gorzula, S. y Señaris, S. 1998. Contribution to the herpetofauna of the Venezuelan Guayana I. A database. Scientiae Guaianae 8:1-270. Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Brusquetti, F. y Lavilla, E. O. 2006. Lista comentada de los anfibios de Paraguay. Cuadernos de Herpetología 20:3-79. Kok, P. y Kalamandeen, M. 2008. Introduction to the Taxonomy of the Amphibians of Kaieteur National Park, Guyana. Abc Taxa: A Series of Manual Dedicated to Capacity Building in Taxonomy and Collection Management, Brussels, Belgium, Belgian Development Corporation 1-288. Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Ponssa, M. L. 2008. Cladistic analysis and osteological descriptions of the frog species in the Leptodactylus fuscus species group (Anura, Leptodactylidae). J Zool Syst Evol Res 46:249-266.PDF Heyer, W. R. 1978. Systematics of the fuscus group of the frog genus Leptodactylus (Amphibia, Leptodactylidae). Bulletin of Los Angeles County Natural History Museum 29:1-85.PDF Prado, C. P. A., Uetanabaro, M., Haddad, C. F. B. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae) with a review on the reproductive specialization toward terrestriality in the genus. Copeia 2002:1128-1133.PDF Lima, A. P., Magnusson, W. E., Menin, M., Erdtmann, L., Rodrigues, D. J., Keller, C., Hödl, W. 2006. Guia de sapos da Reserva Adolpho Ducke, Amazônia Central = Guide to the frogs to Reserva Adolpho Ducke, Central Amazonia. Átemma, Manaus. 168 p. Méhelÿ, L. 1904. Investigations on Paraguayan batrachians. Annales Historico-Naturales Musei Nationalis Hungarici/ Természettudományi Múzeum évkönyve. Budapest 2:207-232. Heyer, W. R. 1983. Clarification of the names Rana mystacea Spix, 1824, Leptodactylus amazonicus Heyer, 1978, and a description of a new species, Leptodactylus spixi (Amphibia: Leptodactylidae). Proceedings of the Biological Society of Washington 96:270-272.PDF Heyer, W. R., García-Lopez, J. M. y Cardoso, A. J. 1996. Advertisement call variation in the Leptodactylus mystaceus species complex (Amphibia: Leptodactylidae) with a description of a new sibling species. Amphibia-Reptilia 17:7-31. Caldwell, J. P. y Lopez, P. T. 1989. Foam-Generating Behavior in Tadpoles of Leptodactylus mystaceus. Copeia 1989:498-502.PDF de Sá, R., Heyer, W. R. y Camargo, A. 2005. Are Leptodactylus didymus and L. mystaceus Phylogenetically Sibling Species (Amphibia, Anura, Leptodactylidae)?. Herpetologia Petropolitana, Ananjeva N. and Tsinenko O. (eds.) 90-92.PDF Toledo, L. F., Castanho, L. M. y Haddad, C. F. 2005. Recognition and distribution of Leptodactylus mystaceus (Anura; Leptodactylidae) in the State of São Paulo, Southeastern Brazil. Biota Neotropica 5:57-62. Heyer, W. R. y Bellin, M. S. 1973. Ecological Notes on Five Sympatric Leptodactylus (Amphibia, Leptodactylidae) from Ecuador. Herpetologica 29:66-72.PDF Amaro-Ghilardi, R. C., Skuk, G., de Sá, R., Rodrígues, M. T. y Yonenaga-Yassuda, Y. 2006. Karyotypes of eight species of Leptodactylus (Anura, Leptodactylidae) with a description of a new karyotype for the genus. Phyllomedusa 5:119-133. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Gazoni, T., Lyra, M., Ron, S., Strüssmann, C., Baldo, D., Narimatsu, H., Pansonato, A., Schneider, R., Giaretta, A., Haddad, C., Parise-Maltempi, P., de Carvalho, T. 2021. Revisiting the systematics of the Leptodactylus melanonotus group (Anura: Leptodactylidae): Redescription of L. petersii and revalidation of its junior synonyms. Zoologischer Anzeiger 290: 117—134. Ouboter, P. E. y Jairam, R. 2012. Amphibians of Suriname. Brill. 388 pp. Jansen, M., Bloch, R., Schulze, A., Pfenninger, M. 2011. Integrative inventory of Bolivia’s lowland anurans reveals hidden diversity. Zoologica Scripta 40:567-583. Gosner, K. L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica 16:183-190. Ponssa, M. L. y Vera Candioti, F. 2012. Patterns of skull development in anurans: size and shape relationship during postmetamorphic cranial ontogeny in five species of the Leptodactylus fuscus Group (Anura: Leptodactylidae). Zoomorphology 131:349-362. Ribeiro, J. W., Lima, A. P., Magnusson, W. E. 2012. The effect of riparian zones on species diversity of frogs in Amazonian forests. Copeia 2012:375-381. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF Straughan, I. R. y Heyer, W. R. 1976. A functional analysis of the mating calls of the Neotropical frog genera of the Leptodactylus complex (Amphibia, Leptodactylidae). Papéis Avulsos de Zoologia 29:221-245. de Sá, R., Grant, T., Camargo, A., Heyer, W. R., Ponssa, M. L., Stanley, E. 2014. Systematics of the neotropical genus Leptodactylus Fitzinger, 1826 (Anura: Leptodactylidae): phylogeny, the relevance of non-molecular evidence, and species accounts. South American Journal of Herpetology 9:S1-S128. Frost, D. R. 2014. Amphibian Species of the World: an Online Reference. Version 6.0 (January 2015). Electronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.html. American Museum of Natural History, New York, USA.
|
