|
Vernacular Name
Rana terrestre de Boulenger
State/Provinces
Orellana, Sucumbíos, Napo, Pastaza, Morona Santiago
Natural Regions
Bosque Húmedo Tropical Amazónico
Identification
Es una rana grande de color café rojizo o grisáceo, línea supralabial crema, muslos negros con puntos amarillos y vientre crema con manchas cafés. Presenta pliegues dorsolaterales conspicuos, dedos sin rebordes cutáneos ni discos expandidos y los machos presentan dos espinas en el pecho. Leptodactylus rhodomystax se asemeja a Leptodactylus mystaceus, Leptodactylus pentadactylus, Leptodactylus rhodonotus y Rana palmipes por la presencia de pliegues dorsolaterales distintivos (5, 16). La especie más similar es Leptodactylus mystaceus por la presencia de una línea supralabial pálida. Se diferencia de esta debido a que Leptodactylus mystaceus es más pequeña (LRC máximo 60 mm), tiene un hocico acuminado en vista lateral (obtuso en Leptodactylus rhodomystax), línea supralabial crema (línea café crema rosácea en Leptodactylus rhodomystax), vientre crema (vientre más obscuro en Leptodactylus rhodomystax), y línea delgada crema a lo largo de la superficie posterior del muslo (manchas redondeadas discretas de color amarillo verdoso o crema sobr eun fondo obscuro en Leptodactylus rhodomystax) (4, 5, 19, 32). Leptodactylus pentadactylus y Leptodactylus rhodonotus tienen barras verticales obscuras en los labios (ausentes en Leptodactylus rhodomystax y Leptodactylus mystaceus, las cuales tienen líneas supralabiales pálidas) (5). El patrón de coloración de la superficie posterior de muslos en Leptodactylus rhodomystax permite su diferenciación también con Leptodactylus rhodonotus y Leptodactylus flavopictus, las cuales presentan un patrón de puntos y motas pero este es irregular y difuso (manchas redondeadas claras discretas en Leptodactylus rhodomystax) (16). Finalmente, Rana palmipes tiene membrana extensa entre los dedos del pie (membrana basal en Leptodactylus rhodomystax) (16).
Description
Leptodactylus rhodomystax es una especie de tamaño grande y cuerpo robusto que presenta la siguiente combinación de caracteres (modificado de Rodríguez y Duellman ( 4), Duellman ( 5), Heyer ( 16), Lima et al. ( 19)): (1) cabeza ancha y hocico redondeado; (2) piel del dorso lisa; pliegue dorso-lateral distintivo delineado de café obscuro se extiende desde el ojo hasta la ingle; pliegue supratimpánico delineado de café obscuro se extiende desde el ojo, pasa por sobre el tímpano y alcanza la base del brazo; pliegue que se extiende desde encima del tímpano hasta un lado del cuerpo ausente; (3) dedos de mano carecen de membrana y de rebordes cutáneos; dedos del pie tienen membrana basal; (4) machos reproductivos tienen una espina pulgar en cada pulgar y un par de espinas en el pecho; (5) superficie dorsal de tibia y región distal del tarso lisas o cubiertas por algunos a muchos tubérculos blancos; planta del pie usualmente lisa, a veces cubierta con algunos tubérculos blancos dispersos.
Color in Life
Modificado de Rodríguez y Duellman ( 4), Duellman ( 5), Heyer ( 16), Lima et al. ( 19): (1) superficie lateral de la cabeza, incluyendo la región timpánica, café obscura; (2) línea supralabial se extiende desde la punta del hocico hasta la base del brazo y varía de café claro a gris o crema, pero siempre impregnada de una fuerte tonalidad rosácea pálida; (3) dorso varía de rojizo intenso a café grisáceo uniforme con o sin bandas estrechas transversales; flancos de color café claro anaranjado; (4) superficie dorsal de tibia con bandas amplias o estrechas más obscuras, o totalmente uniforme sin presentar ningún patrón; (5) ingle y superficie posterior de muslos de color café obscuro o negro con pequeños puntos o manchas redondeadas discretas de color amarillo verdoso pálido o crema; (6) garganta café obscura; pecho, vientre y superficies ventrales de extremidades de color crema, pero fuertemente impregnadas de café; (7) iris bronce apagado dorsalmente y bronce rojizo ventralmente.
Males Face Cloacal Length Average
promedio = 80.2 mm (máximo 89.6) (16
Females Face Cloacal Length Average
promedio = 76.5 mm (máximo 83.8) (16
Habitat and Biology
Leptodactylus rhodomystax es una especie terrestre y nocturna que puede ser encontrada en la hojarasca de bosque primario y secundario, así como en borde y claros de bosque, frecuentemente en la cercanía de cuerpos hídricos (4, 5, 10, 19, 25). Leptodactylus rhodomystax puede ser común y relativamente abundante en bosque secundario o explotado que se caracteriza, a diferencia de bosque primario, por un dosel más abierto y la presencia de cuerpos de agua pequeños y superficiales, pero persistentes (17). La especie es menos frecuentemente observada e inclusive rara dentro de bosque primario (24), por lo que ha sido sugerido que no tiene requerimientos de hábitat específicos y tiene una alta tolerancia fisiológica a diversas condiciones ambientales (17). En sitios de bosque primario en Guyana, la especie fue igualmente abundante que Leptodactylus knudseni; mientras que en hábitats alterados, Leptodactylus rhodomystax fue más abundante (17). La reproducción ocurre principalmente durante la estación lluviosa (10, 17). La especie se reproduce tanto en pozas temporales como permanentes en bosque de tierra firme y bosque de palmas (24). Los machos comienzan a vocalizar con el inicio de las lluvias desde las cercanías de pozas secas que se encuentran en los márgenes de riachuelos permanentes (19, 24). La actividad de vocalización ocurre entre las 19:00 y 23:00, y los machos no se asocian en coros por lo que es frecuente encontrar únicamente un macho por sitio (24).
La pareja en amplexus construye un nido de espuma que contiene alrededor de 250 huevos de 3 mm de diámetro, el cual es depositado en depresiones naturales en la cercanía de las pozas secas en el piso entre arbustos, raíces o troncos (4, 19, 23). Toft y Duellman (7) presentan el Modo reproductivo 5, con huevos depositados en nidos de espuma sobre o cerca del agua y renacuajos acuáticos (9). Los sitios de oviposición pueden permanecer sin ser inundados por un mes, tiempo en el cual los renacuajos sobreviven dentro de la espuma del nido; durante este periodo muchos nidos se echan a perder (19). La principal causa de la mortalidad de los nidos se debe a la depredación por parte de larvas de moscas y por parte de cangrejos de agua dulce de la familia Pseudothelphusidae (17). Las lluvias subsecuentes inundan los nidos que logran sobrevivir y los renacuajos son transportados a las pozas donde completan su desarrollo. Los renacuajos son negros, no son agrupan en escuelas (19), se encuentran entre la hojarasca del fondo de las pozas y pueden ser importantes depredadores de huevos y larvas de especies inter- y con-específicas (23). Tres individuos adultos de Leptodactylus rhodomystax contuvieron en sus estómagos dos cucarachas, un grillo y un milípedo (5). Se han encontrado machos y juveniles de Leptodactylus rhodomystax en pozas permanentes de agua lluvia dentro de bosque de tierra firme, las mismas que fueron frecuentadas por machos del microhílido Chiasmocleis shudikarensis, y también han sido encontrados en pozas semi-permanentes utilizadas por Phyllomedusa sp. (24).
Distribution
Leptodactylus rhodomystax se distribuye en la Amazonía de Colombia, Ecuador, Perú, Bolivia, norte y centro de Brasil, sur de Venezuela, Guyana, Guayana Francesa y Surinam (19, 26, 27, 32).
Altitudinal Range
< 500 m sobre el nivel del mar (6, 26).
Taxonomy and Evolutionary Relationships
Según de Sá et al. ( 32) Leptodactylus rhodomystax está cercanamente relacionada a Leptodactylus rhodonotus, Leptodactylus rugosus y Leptodactylus lithonaetes. Forma parte del grupo de especies Leptodactylus pentadactylus ( 2, 16, 32). Por otra parte, Jansen et al. ( 30) consiguieron ubicar a Leptodactylus rhodomystax dentro del grupo fuscus en su filogenia molecular, e indican también que su clado hermano contiene a Leptodactylus elenae ( Leptodactylus didymus + Leptodactylus notoaktites). En la filogenia de Jetz y Pyron ( 33) Leptodactylus rhodomystax está cercanamente relacionada a Leptodactylus silvanimbus + Leptodactylus riveroi.
Etymology
Su nombre deriva del griego “rhodon” que significa rosa y “mystax” que significa labio superior; en referencia a la línea color rosa sobre su labio superior.
Additional Information
Zimmerman y Bogart (24) describen el canto y presentan un audioespectrograma de sitios de bosque no disturbado. La frecuencia dominante es de 3700-5400 Hz. La duración del canto es de 0.12-0.23 s con un solo pulso por nota. Estructura armónica presente. La especie fue incluida en claves de identificación para adultos del género Leptodactylus presentes en Ecuador (6) y para el complejo pentadactylus (31). La variación morfológica en cuanto a coloración de cabeza, dorso, muslos y pantorrillas de las especies dentro del grupo pentadactylus fue ilustrada por Heyer (31). Hero (28) incluye esta especie en una clave de identificación para renacuajos de la Amazonía central, Brasil. Duellman (5) y Rodríguez y Duellman (4) presentan fotografías en vista dorsolateral de especímenes de Santa Cecilia, Ecuador e Iquitos, Perú, respectivamente. Duellman (5) describe también un renacuajo de Santa Cecilia, Ecuador. Zimmerman (11) realiza una comparación de la estructura del canto entre especies de bosque (incluida aquí Leptodactylus rhodomystax) vs. especies de áreas abiertas en la Amazonía Central, Brasil, indicando que las especies de bosque tienen una Longitud Rostro-cloacal mayor y una frecuencia dominante más baja que especies de áreas abiertas. Gorzula y Señaris (8) reportan el primer registro confirmado para Guyana. Lescure y Marty (12) proveen una fotografía y un relato de especímenes de la Guayana Francesa. Lima et al. (19) presentan fotografías de un macho y una hembra en vista dorsolateral, de un macho en vista ventral, la superficie oculta del muslo y un macho vocalizando. Rodrigues et al. (23) describen el renacuajo en detalle. Kok y Kalamandeen (13) proporcionan un relato y la incluyen en su clave de identificación de Leptodactylus del Parque Nacional Kaieteur, Guyana. MacCulloch y Lathrop (21) comentaron acerca de especímenes del Monte Ayanganna, Guyana. Ron et al. (3) provee una fotografía en vida de un individuo en vista posterior. Ouboter y Jairam (29) proveen un escrito sobre especímenes de Surinam. Pedroso-Santos et al. describen el comportamiento de defensa basado en observaciones de campo en Maxson y Heyer (22) realizan un análisis bioquímico de albúminas para varias especies de Leptodactylus, indicando que la mayor diversificación del género ocurrió durante el Paleoceno (65.5–55.5 millones de años) (22). Heyer (31) propone una representación diagramática de las relaciones entre grupos de especies dentro de Leptodactylus e indican que el grupo fuscus es el menos relacionado a los demás grupos; así las relaciones de los grupos serían: fuscus (pentadactylus (melanonotus + ocellatus).
Heyer (31) y Prado et al. (18) postularon que Leptodactylus y Adenomera constituyen un grupo que ha experimentado transición desde el medio acuático hacia el terrestre, y que la gran diversidad de los sitios de oviposición de nidos de espuma entre especies abarca un amplio rango de esta transición. Siguiendo este razonamiento, los grupos de especies desde el más primitivo al más derivado son: melanonotus + ocellatus (nido en la superficie del agua), pentadactylus (nidos en cavidades adyacentes al agua), fuscus (nidos en cámaras de incubación y larva acuática), y Adenomera (nidos en cámaras de incubación y larva no acuática). También existe una relación en reducir el tamaño de la puesta y aumentar el diámetro de los huevos conforme un grupo es más terrestre (31). Bogart (15) y Amaro-Ghilardi et al. (20) sugieren que la condición de 26 cromosomas es primitiva en Leptodactylus, y que los linajes más derivados experimentaron una reducción a 22 o 24 cromosomas; sin embargo, Heyer y Diment (14) indican que el uso de cariotipos en develar las relaciones filogenéticas en Leptodactylidae es de uso limitado, y tiene que ser usado en combinación con otros sets de datos.



Summary Author
Diego A. Ortiz, Morley Read, Andrea Varela-Jaramillo y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2013-10-08T00:00:00
Update Date
2022-09-26T20:31:10.393
Literature Cited
Boulenger, G. A. 1884. On a collection of frogs from Yurimaguas, Huallaga River, Northern Peru. Proceedings of the Zoological Society of London 1883:635-638. Heyer, W. R. 1972. The status of Leptodactylus pumilio Boulenger (Amphibia, Leptodactylidae) and the description of a new species of Leptodactylus from Ecuador. Contributions in Science 231:1-8.PDF Ron, S. R., Bustamante, M. R., Coloma, L. A. y Mena, B. 2009. Sapos, Ecuador sapodiverso. Serie de Divulgación del Museo de Zoología. Centro de Biodiversidad y Ambiente, Pontificia Universidad Católica del Ecuador 10:256. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Heyer, W. R. y Peters, J. A. 1971. The frog Genus Leptodactylus in Ecuador. Proceedings of the Biological Society of Washington 84:163-170. Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Gorzula, S. y Señaris, S. 1998. Contribution to the herpetofauna of the Venezuelan Guayana I. A database. Scientiae Guaianae 8:1-270. Crump, M. 1974. Reproductive strategies in a tropical anuran community. Miscellaneous Publications of the Museum of Natural History. University of Kansas 61:1-68.PDF Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Zimmerman, B. L. 1983. A Comparison of Structural Features of Calls of Open and Forest Habitat Frog Species in the Central Amazon. Herpetologica 39:235-246 . Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Kok, P. y Kalamandeen, M. 2008. Introduction to the Taxonomy of the Amphibians of Kaieteur National Park, Guyana. Abc Taxa: A Series of Manual Dedicated to Capacity Building in Taxonomy and Collection Management, Brussels, Belgium, Belgian Development Corporation 1-288. Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Heyer, W. R. 1979. Systematics of the pentadactylus species group of the frog genus Leptodactylus (Amphibia: Leptodactylidae). Smithsonian Contributions to Zoology 301:1-43.PDF Ernst, R., Konrad, T., Linsenmair, K. E. y Rödel, M. M. 2007. The impacts of selective logging on three sympatric species of Leptodactylus in a Central Guyana rainforest.. 28:51-64. Prado, C. P. A., Uetanabaro, M., Haddad, C. F. B. 2002. Description of a new reproductive mode in Leptodactylus (Anura, Leptodactylidae) with a review on the reproductive specialization toward terrestriality in the genus. Copeia 2002:1128-1133.PDF Lima, A. P., Magnusson, W. E., Menin, M., Erdtmann, L., Rodrigues, D. J., Keller, C., Hödl, W. 2006. Guia de sapos da Reserva Adolpho Ducke, Amazônia Central = Guide to the frogs to Reserva Adolpho Ducke, Central Amazonia. Átemma, Manaus. 168 p. Amaro-Ghilardi, R. C., Skuk, G., de Sá, R., Rodrígues, M. T. y Yonenaga-Yassuda, Y. 2006. Karyotypes of eight species of Leptodactylus (Anura, Leptodactylidae) with a description of a new karyotype for the genus. Phyllomedusa 5:119-133. MacCulloch, R. D. y Lathrop, A. 2009. Herpetofauna of Mount Ayanganna Guyana: Results of the Royal Ontario Museum Ayanganna Expedition 2000. Royal Ontario Museum Contributions in Science 4:1-35. Maxson, L. R. y Heyer, W. R. 1988. Molecular systematics of the frogs genus Leptodactylus (Amphibia: Leptodactylidae). Fieldiana, Zoology, New Series 41:1-13. Rodrigues, D. J., Menin, M. y Lima, A. P. 2007. Redescription of the tadpole of Leptodactylus rhodomystax (Anura: Leptodactylidae) with natural history notes. Zootaxa 1509:61-67. Zimmerman, B. L. y Bogart, J. P. 1988. Ecology and Calls of Four Species of Amazonian Forest Frogs. Journal of Herpetology 22:97-108. Duellman, W. E. y Mendelson III, J. R. 1995. Amphibians and reptiles from northern departamento Loreto, Peru: Taxonomy and biogeography. University of Kansas Science Bulletin, 55:329-376.PDF IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Frost, D. R. 2013. Amphibian Species of the World: an online reference. Version 5.6 (15 October, 2012). Base de datos accesible en http://research.amnh.org/vz/herpetology/amphibia/ American Museum of Natural History, New York, USA. Hero, J. M. 1990. An illustrated key to tadpoles occurring in the central Amazon rainforest, Manaus, Amazonas, Brasil. Amazoniana 11:201-262. Ouboter, P. E. y Jairam, R. 2012. Amphibians of Suriname. Brill. 388 pp. Jansen, M., Bloch, R., Schulze, A., Pfenninger, M. 2011. Integrative inventory of Bolivia’s lowland anurans reveals hidden diversity. Zoologica Scripta 40:567-583. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF de Sá, R., Grant, T., Camargo, A., Heyer, W. R., Ponssa, M. L., Stanley, E. 2014. Systematics of the neotropical genus Leptodactylus Fitzinger, 1826 (Anura: Leptodactylidae): phylogeny, the relevance of non-molecular evidence, and species accounts. South American Journal of Herpetology 9:S1-S128. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|


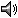



 Map of Life
Map of Life



