|
Vernacular Name
Sapo de la caña
State/Provinces
Loja, Morona Santiago, Napo, Orellana, Pastaza, Sucumbíos, Tungurahua, Zamora Chinchipe
Natural Regions
Bosque Montano Oriental, Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
En un sapo de tamaño variable entre grande y muy grande de color café. Carece de discos expandidos en los dedos y tiene glándulas parotoideas grandes y prominentes. Presenta membrana entre los dedos de los pies. La especie ecuatoriana más parecida es Rhinella bella. Difieren por la morfología ósea de la región maxilar, frontoparietal y occipital (visibles con rayos X) que resulta en una forma del hocico ligeramente más redondeada en Rhinella marina. La especie simpátrica más similar es Rhinella poeppigii que se diferencia por tener glándulas parotoideas subtriangulares y poco definidas (glándulas parotoideas prominentes y bien definidas en Rhinella marina). Rhinella margaritifera y Rhinella dapsilis tienen una fila oblicuolateral de tubérculos cónicos desde la glándula parotoidea hasta la ingle (ausente en Rhinella marina). Se diferencia de bufónidos del género Rhaebo por la presencia de crestas craneales (bajas pero notorias en Rhinella marina; ausentes en Rhaebo) y tubérculos y verrugas conspicuas en el dorso (ausentes en Rhaebo). Además, Rhaebo guttatus presenta una cresta preocular conspicua que interrumpe el canto rostral (ausente en Rhinella marina) y superficies ventrales oscuras con puntos blancos grandes (superficies ventrales blancas cremosas con manchas oscuras en Rhinella marina). La combinación de crestas craneales, tubérculos en el dorso y membrana extensa entre los dedos del pie distingue a juveniles de Rhinella marina de especies pequeñas de bufónidos como Amazophrynella siona y de individuos pequeños de Oreobates quixensis y Pristimantis sulcatus ( 4, 16, 19).
Description
Es un sapo de tamaño grande que se caracteriza por: (1) piel dorsal tuberculada con tubérculos medianos y redondeados usualmente con una espícula queratinizada en la punta, con o sin verrugas grandes dispersas; (2) hocico corto, sin una protuberancia ósea en el ángulo de la mandíbula, subacuminado en vista dorsal, truncado a redondeado de perfil; (3) crestas craneales bajas; (3) crestas cantales, preorbitales, supraorbitales, postorbitales y supratimpánicas continuas, bajas y gruesas; crestas labiales y parietales menos evidentes; presenta o no crestas suborbitales delgadas; (4) glándulas parotoideas grandes y prominentes, ovales a subtriangulares; (5) tímpano visible; (6) primer dedo más largo que el segundo; (7) excrescencias nupciales variables desde manchas café claras no prominentes en el primer dedo hasta manchas conspicuas, de color café oscuro en el primer, segundo y tercer dedo; (8) carece de filas de tubérculos espiculados en el borde de los flancos, muslos y tarsos, presenta un pliegue tarsal interno; (10) dedos de los pies y las manos robustos, con pliegues cutáneos laterales, distalmente terminan en nudos; (9) presenta membranas entre los dedos de los pies.
Color in Life
En vida, la coloración dorsal varía de café claro a oscuro, con o sin tonalidades amarillentas, anaranjadas o rojizas. Pueden tener manchas negras o café oscuras dispersas en el dorso y pueden presentar la punta de sus tubérculos o verrugas grandes de color rojo. Presenta o no barras labiales, cantales supratimpánicas o barras transversales en las extremidades de color gris o café oscuro. El vientre es blanco moteado o no de gris. El iris es amarillo o dorado pálido con reticulaciones negras (20).
Males Face Cloacal Length Average
promedio = 97.7 mm (rango 75.65–119.48; n = 10) en Ecuador; (rango 102–130 mm) en la Amazonía Peruana (4, 20
Females Face Cloacal Length Average
promedio = 105.4 mm (rango 87.94–133.01; n = 10) en Ecuador; (rango 110–150 mm) en la Amazonía Peruana (4, 20
Habitat and Biology
Es nocturna y terrestre, generalmente habita en áreas abiertas, naturales o artificiales incluyendo zonas agrícolas, potreros, jardines, caminos y carreteras, en el borde de ríos, riachuelos o canales; casi nunca se la encuentra dentro de bosques. Por el día permanece oculta bajo árboles u hojas de palma caídas y vegetación similar. Es una especie común tanto en época seca como lluviosa. Los huevos y renacuajos se desarrollan en agua estancada y de poca corriente en charcas, zanjas, estanques temporales, reservorios, canales y riachuelos. Es común observar agregaciones de 30–50 renacuajos alimentándose en agua poco profunda. (4, 5, 6, 9, 10, 11, 20). Se han realizado varios estudios sobre el impacto de poblaciones introducidas en Australia. La toxicidad de los huevos y adultos le sirve como defensa contra predadores; se ha reportado muertes de aves, reptiles (e.g. cocodrilos, serpientes y grandes lagartijas) y mamíferos, incluyendo perros y humanos, después de la ingestión de adultos. La ingestión de sus huevos también puede causar mortalidad masiva en renacuajos de otras especies. Poblaciones introducidas de esta especie han sido altamente invasivas, han ocupado refugios y depredado huevos y juveniles de otras especies como el ave Merops ornatos (21, 22, 23).
Reproduction
Es una especie altamente versátil en sus requerimientos reproductivos. Los machos cantan desde el borde de pozas temporales a lo largo de todo el año, pero son más frecuentes en noches con poca o sin lluvia. El amplexus es axilar y la pareja flota en el agua mientras deposita los huevos. El tamaño de la puesta varía entre 4000 y más de 30000 huevos. Los huevos miden hasta 2 mm de diámetro. Una hembra de la Amazonía de Ecuador contuvo 30545 huevos en su cavidad abdominal, mientras que uno de sus oviductos al ser desplegado linearmente midió 1.36 m de longitud (4, 5, 10, 11). Estudios experimentales sugieren que los machos modifican su comportamiento de búsqueda de pareja y amplexus en respuesta a los cantos de conespecíficos. Se encontró que los machos son 7 veces más propensos a efectuar un amplexus y que se desplazan dos veces más bajo el estímulo de un coro de conespecíficos que bajo un ruido control o en silencio. Señales no acústicas también afectaron su comportamiento: se encontró que los machos son entre 5 a 16 veces más propensos a amplexar un individuo en movimiento que uno estacionario, independientemente del sexo del individuo siendo amplexado (24).
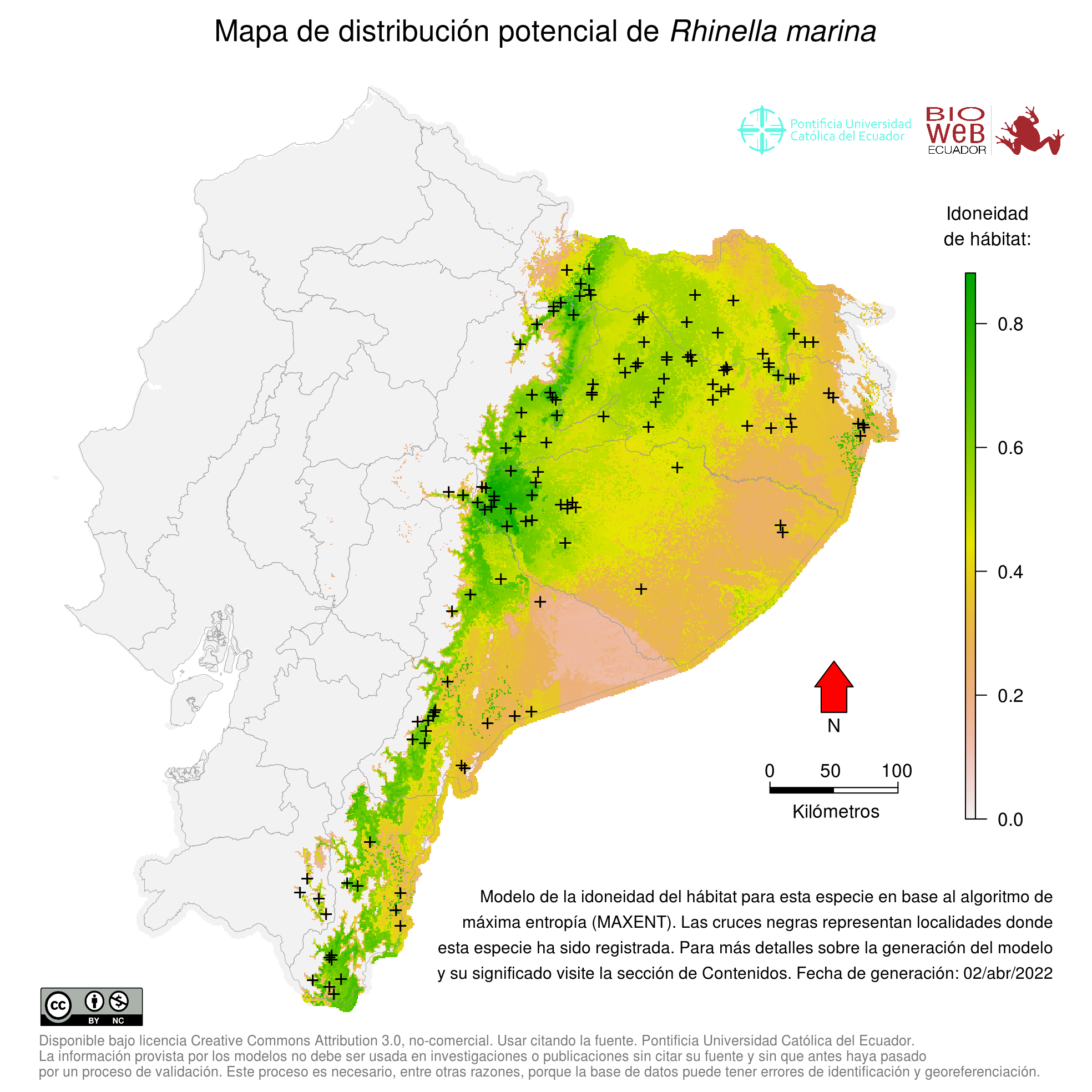
Distribution
Desde Venezuela hasta Brasil, con distribución oriental a la Cordillera de los Andes ( 19). En Ecuador se encuentra en estribaciones orientales de los Andes y Amazonía. Introducida en las Antillas, Hawaii, Fiji, Filipinas, Taiwan, Japón, Nueva Guinea, Australia y muchas islas del Pacífico ( 18).
Altitudinal Range
de 50 a 1665 m sobre el nivel del mar (en Ecuador)
Taxonomy and Evolutionary Relationships
Miembro del grupo de especies Rhinella marina. Está cercanamente relacionada a Rhinella diptycha y Rhinella horribilis (25).
Etymology
El epíteto específico deriva del latín marinus que significa marino. Probablemente Linneo seleccionó este nombre a partir de la descripción de Seba (12). Aunque ningún anfibio puede vivir por períodos prolongados en agua de mar, hay registros anecdóticos de Rhinella marina nadando en el mar lo cual sugiere una resistencia moderada.
Additional Information
Duellman (5) provee una fotografía en vida, e información sobre su morfología, distribución, historia natural, vocalización, y dieta de adultos y renacuajos en Santa Cecilia y alrededores (Provincia de Sucumbíos, Amazonía de Ecuador). Easteal (8) provee amplia información sobre morfología, biología, ecología, historia natural y distribución. Almendáriz (6) provee datos de morfología, historia natural y dieta de especímenes de la Amazonía centro-oriental de Ecuador. De la Riva (7) compara a Rhinella marina con Rhinella poeppigii y reconoce la validez de esta última como una especie distinta. Pramuk (3) presentan una descripción de caracteres morfológicos utilizados en su estudio de las relaciones evolutivas dentro de Bufonidae. También presenta ilustraciones del cráneo (vistas dorsal, ventral y lateral), de la columna vertebral (vista dorsal), y de la región posterolateral de la órbita. Kwet et al. (15) presentan una clave de identificación del grupo Rhinella marina. Ron et al. (2) presentan una fotografía de una pareja en amplexus. Sus secreciones glandulares han sido utilizadas en flechas como veneno por cazadores. Triana (17) provee información sobre la frecuencia de muda entre juveniles y adultos y la tasa de ocurrencia entre el día y la noche. Previamente, las poblaciones de Centro y Sudamérica se conocían bajo el nombre de Rhinella marina; Vallinoto et al. (14) presentan evidencia genética de que estas poblaciones no son monofiléticas y pertenecen a tres linajes distintos: uno de América Central, uno de la región pacífica de Ecuador y otro de la Cuenca Amazónica. Acevedo et al. (19) revalidan el nombre de Rhinella horribilis para las poblaciones de Centroamérica y de Sudamérica distribuidas al occidente de los Andes, y determinan como Rhinella marina a las poblaciones de Sudamérica con distribución oriental a los Andes. Rhinella marina tuvo su origen en Sudamérica y el levantamiento de los Andes separó sus linajes más antiguos, uno al este y otro al oeste de los Andes, hace 13.9 millones de años (14). Subsecuentemente, el linaje del oeste colonizó América Central previo al cierre total del istmo de Panamá. Su separación se dio hace aproximadamente 9.1 millones de años. (14). Ver sinónimos y comentarios taxonómicos en Frost (18).



Summary Author
Luis A. Coloma, Nadia Páez-Rosales, Diego A. Ortiz, Caty Frenkel, Santiago R. Ron, Gabriela Pazmiño-Armijos y Diego A. Paucar
Editor
Santiago R. Ron
Edition Date
2018-08-08T00:00:00
Update Date
2024-03-19T18:50:14.93
Literature Cited
Linnaeus, C. 1758. Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. Laurentii Salvii, Holmiæ, 824 pp.PDF Ron, S. R., Bustamante, M. R., Coloma, L. A. y Mena, B. 2009. Sapos, Ecuador sapodiverso. Serie de Divulgación del Museo de Zoología. Centro de Biodiversidad y Ambiente, Pontificia Universidad Católica del Ecuador 10:256. Pramuk, J. B. 2006. Phylogeny of South American Bufo (Anura: Bufonidae) inferred from combined evidence. Zoological Journal of the Linnean Society 146:407-452.PDF Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Almendáriz, A. 1987. Contribución al conocimento de la herpetofauna centroriental ecuatoriana. Revista Politécnica 12:77-133.PDF De la Riva, I. 2002. Taxonomy and distribution of the South American toads, Bufo poeppigii Tschudi, 1845 (Amphibia, Anura, Bufonidae). Graellsia 58:49-57. Easteal, S. 1986. Bufo marinus. Catalogue of American Amphibians and Reptiles 395:1-4. Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Crump, M. 1974. Reproductive strategies in a tropical anuran community. Miscellaneous Publications of the Museum of Natural History. University of Kansas 61:1-68.PDF Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Seba, A. 1734. Locupletissimi Rerum Naturalium Thesauri Accurata Descriptio, et Iconibus Artificiosissimus Expressio, per Universam Physices Historium. Opus, cui in hoc Rerum Genere, Nullum par Exstitit. Amsterdam: Janssonio-Waesbergios 1 Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Vallinoto, M., Sequeira, F., Sodré, D., Bernardi, J. A. R., Sampaio, I., Schneider, H. 2010. Phylogeny and biogeography of the Rhinella marina species complex (Amphibia, Bufonidae) revisited: implications for Neotropical diversification hypotheses. Zoologica Scripta 39:128-140. Kwet, A., Di-Bernardo, M. y Maneyro, R. 2006. First record of Chaunus achavali (Anura, Bufonidae) from Rio Grande do Sul, Brazil, with a key for the identification of the species in the Chaunus marinus group. Iheringia, Série Zoologia 96:479-485. Venegas, P. J. y Ron, S. R. 2014. First records of Rhinella poeppigii (Tschudi 1845) from Ecuador, with a distribution map (Anura: Bufonidae). Herpetology Notes 7:713-716.PDF Triana Velasquez, T. M., Henao, L. M. y Bernal, M. H. 2013. Comparación ontogénica de la frecuencia de muda en Rhinella marina (Anura, Bufonidae). Iheringia Série Zoologia 103(1). Frost, D. R. 2016. Amphibian Species of the World: an Online Reference. Version 6.0 (Date of access). Electronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.html. American Museum of Natural History, New York, USA. Acevedo, A. A., Lampo, M., Cipriani, R. 2016. The cane or marine toad, Rhinella marina (Anura, Bufonidae): two genetically and morphologically distinct species. Zootaxa 4103 (6): 574–586. doi: 10.11646/zootaxa.4103.6.7 . Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Letnic, M., Webb, J. K. y Shine, R. 2008. Invasive cane toads (Bufo marinus) cause mass mortality of freshwater crocodiles (Crocodylus johnstoni) in tropical Australia. Conservation Biology 141:1773-1782. Crossland, M. R., Brown, G. P., Anstis, M., Shilton, C. M., Shine, R. 2008. Mass mortality of native anuran tadpoles in tropical Australia due to the invasive cane toad (Bufo marinus). Biological Conservation 141:2387-2394. Boland, C. R. J. 2004. Introduced cane toads Bufo marinus are active nest predators and competitors of rainbow bee-eaters Merops ornatus: observational and experimental evidence. Biological Conservation 120:53-62. Clarke, G., Shine, R., Phillips, B. 2019. Whispers on the wind: male cane toads modify mate searching and amplexus tactics based on calls from other males. Animal Behaviour 153: 131—136. Pereyra, M., Blotto, B., Baldo, D., Chaparro, J., Ron, S., Elias-Costa, A., Iglesias, P., Venegas, P., Thome, M., Ospina-Sarria, J., Maciel, N., Rada, M., Kolenc, F., Borteiro, C., Rivera-Correa, M., Rojas-Runjaic, F., Moravec , J., de la Riva, I., Wheeler, W., Castroviejo-Fisher, S., Grant, T., Haddad, C., Faivovich, J. 2021. Evolution in the Genus Rhinella: A Total Evidence Phylogenetic Analysis of Neotropical True Toads (Anura: Bufonidae) Bulletin of the American Museum of Natural History 447: 1—156.
|
