|
Vernacular Name
Rana mono verde naranja
State/Provinces
Napo, Orellana, Pastaza, Morona Santiago, Sucumbíos
Natural Regions
Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
Es una rana grande de color verde con puntos blancos dispersos, ingles y superficies internas de las extremidades naranjas con franjas púrpura y vientre naranja pálido. Presenta pupila vertical, calcares, piel dorsal lisa, discos expandidos en los dedos y membrana entre los dedos del pie ausente. En la Amazonía ecuatoriana, las únicas otras especies verdes con marcas anaranjado brillantes en los flancos y muslos son Phyllomedusa palliata y Phyllomedusa ecuatoriana; que se diferencian de Phyllomedusa tomopterna por tener manchas púrpuras extensas en los flancos, discos digitales más pequeños y no tener calcares.
Description
Phyllomedusa tomopterna es una rana de tamaño medio que presenta la siguiente combinación de caracteres (revisado de Duellman (6)): (1) el hocico es truncado en machos y redondeado en hembras; (2) las glándulas parotoideas son difusas y generalmente no evidentes; (3) la piel dorsal es lisa, la ventral es granular; (4) los discos son grandes; (5) las membranas entre los dedos de pies y manos están ausentes; (6) el primer dedo del pie es oponible y apenas más largo que el segundo; (7) los talones tienen calcares grandes.
Color in Life
Las superficies del dorso y los lados de la cabeza son verdes; los flancos y las superficies ocultas de los miembros son anaranjado brillante con barras verticales definidas púrpuras; la garganta y el pecho son blancos, el vientre es naranja pálido; el iris es gris plateado con una pupila vertical; los machos en época reproductiva tienen excrecencias nupciales marrón (6).
Males Face Cloacal Length Average
Promedio = 53.2 mm (rango 50.2–57.5; n = 18) (7
Females Face Cloacal Length Average
Promedio = 76.7 mm (rango 68.8–81.2; n = 5) (7
Habitat and Biology
Especie arbórea que habita en bosques húmedos tropicales primarios y secundarios (19). Generalmente es observada en árboles alrededor de pozas temporales y semi-temporales durante la estación lluviosa (16). Pone los huevos en un nido generalmente hecho de una sola hoja doblada, encima del agua (M. Read notas del campo). En Santa Cecilia, Provincia de Sucumbíos, Ecuador, fue registrada por la noche en arbustos y árboles bajos, en el bosque (6). En el Parque Nacional Yasuní, Ecuador, ha sido registrada en áreas abiertas y bosques inundables al borde de cuerpos de agua (2).
Reproduction
Los machos cantan desde arbustos junto a pozas y los renacuajos se desarrollan en pozas (6). Las parejas en amplexus depositan sus huevos sobre hojas que luego son dobladas formando un nido (S. R. Ron obs. pers.) Los nidos son atacados por depredadores incluyendo escarabajos estafilínidos, moscas de la familia Phoridae, mamíferos y otros. El 59% de las puestas de Phyllomedusa tomopterna fue atacado por depredadores en la Amazonía central (15). En Yasuní, la serpiente Leptodeira annulata se encuentra a menudo en los sitios de reproducción de Phyllomedusa y se puede alimentar de sus huevos (M. Read notas del campo).
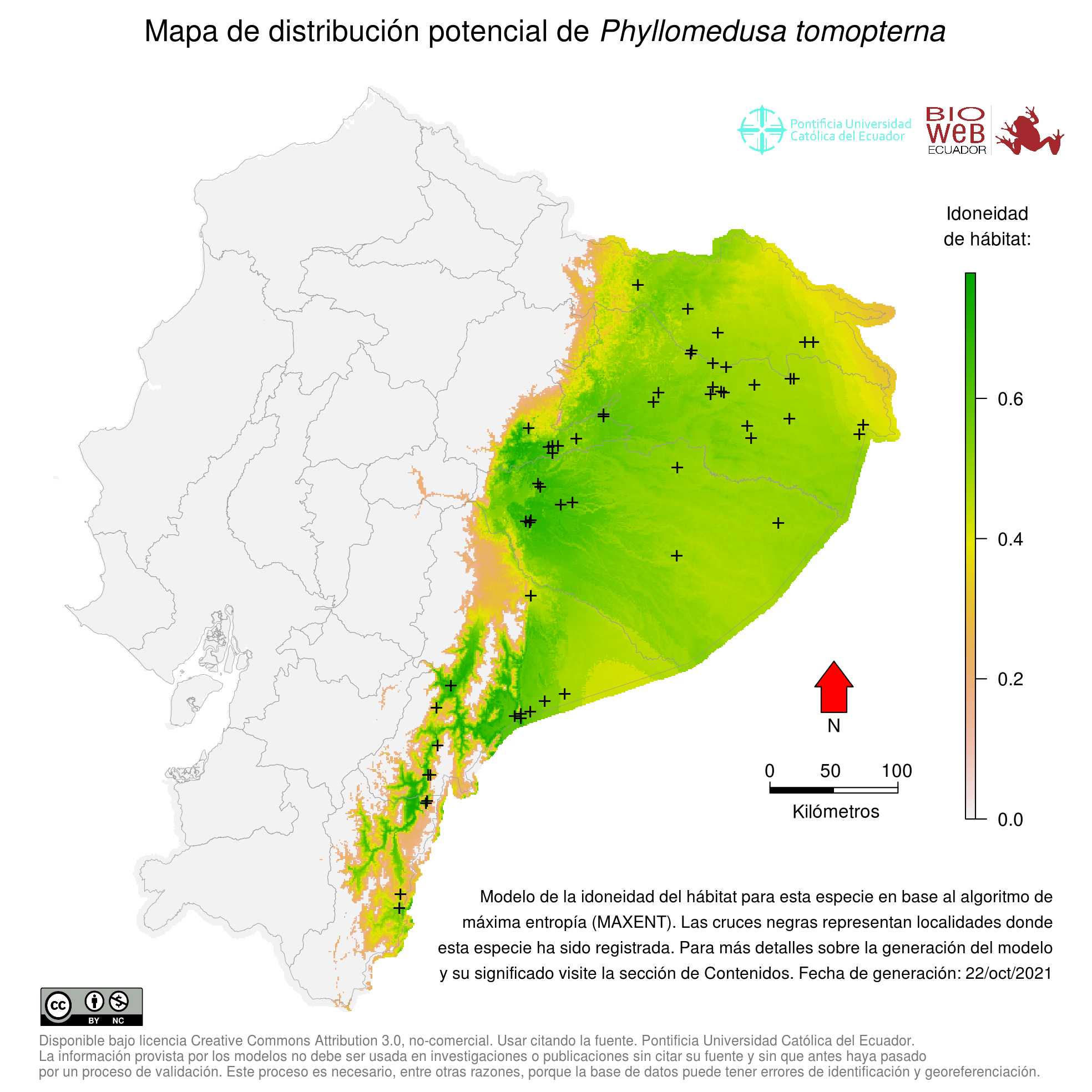
Distribution
Cuenca alta del Amazonas en Colombia, Ecuador, Perú, y Bolivia; región guayanesa, del sudeste de Venezuela hasta la Guayana Francesa; Amazonía brasileña (11). Barrio-Amorós (8) comenta sobre su distribución en Venezuela.
Taxonomy and Evolutionary Relationships
Parte del grupo Phyllomedusa perinesos. Especie hermana de un clado conformado por Phyllomedusa atelopoides, Phyllomedusa duellmani, Phyllomedusa ecuatoriana y Phyllomedusa perinesos ( 17, 20). Los ejemplares incluidos en las filogenias de Fouquet et al. ( 11), Faivovich et al. ( 12) y Ron et al. ( 17) exhiben un nivel de divergencia genética que podría indicar la existencia de especies crípticas. Fue transferida al género Callimedusa por Duellman et al. ( 18) pero Anfibios del Ecuador no ha adoptado ese cambio en favor de la estabilidad taxonómica del grupo.
Additional Information
Gascón ( 13) investigó el papel de los depredadores en la organización de ensambles de renacuajos, usando larvas de Phyllomedusa tomopterna y otras dos especies. Gascón ( 14) investigó el papel de su fenología reproductiva en la supervivencia y crecimiento de los renacuajos. Lescure y Marty ( 9) presentan una breve sinopsis y foto para la Guayana Francesa. El renacuajo está descrito en Duellman ( 6).



Summary Author
Santiago R. Ron y Morley Read
Editor
Santiago R. Ron
Edition Date
2012-10-20T00:00:00
Update Date
2022-09-26T17:35:02.997
Literature Cited
Menéndez-Guerrero, P. 2001. Ecología trófica de la comunidad de anuros del Parque Nacional Yasuní en la amazonía ecuatoriana. Tesis de Licenciatura. Pontificia Universidad Católica del Ecuador. Escuela de Biología. Quito.PDF Ron, S. R. 2001-2011. Anfibios de Parque Nacional Yasuní, Amazonía ecuatoriana. [en línea]. ver. 1.7 (2011). Museo de Zoología, Pontificia Universidad Católica del Ecuador. Quito, Ecuador. Cope, E. D. 1868. An examination of the reptilia and batrachia obtained by the Orton expedition to Equador and the upper Amazon, with notes on other species. Proceedings of the Academy of Natural Sciences of Philadelphia 20:96-140. Faivovich, J., Haddad, C. F., García, P. C., Frost, D. R., Campbell, J. A. y Wheeler, W. C. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History 294:1-240.PDF Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. Miscellaneous Publications of the University of Kansas 65:1-352.PDF Duellman, W. E. 1974. Taxonomic notes on Phyllomedusa (Anura: Hylidae) from the upper Amazon Basin. Herpetologica 30:105-112.PDF Barrio-Amoros, C. L. 1998. Sistemática y Biogeografía de los Anfibios (Amphibia) de Venezuela. Acta Biologica Venezuelica 18:1-93. Lescure, J. y Marty, C. 2000. Atlas des Amphibiens de Guyane. Collect. Patrimoines Nat., Paris 45:138-139. Fouquet, A., Gilles, A., Vences, M., Marty, C., Blanc, M., Gemmel, N. J. 2007. Underestimation of species richness in neotropical frogs revealed by mtDNA analyses. PLoS one 2:1-10. doi:10.1371/journal.pone.0001109PDF Frost, D. R. 2010. Amphibian species of the world: an online reference. Version 5.4 (8 April, 2010). Electronic Database accessible at http://research.amnh.org/vz/herpetology/amphibia/. American Museum of Natural History, New York, USA. Faivovich, J., Haddad, C. F., Baêta, D., Jungfer, K., Alvarez, G. F., Brandao, R. A., Sheil, C. A., Barrientos, L. S., Barrio-Amorós, C., Cruz, C. A. y Wheeler, W. C. 2010. The phylogenetic relationships of the charismatic poster frogs, Phyllomedusinae (Anura, Hylidae). Cladistics 25:227–261.Enlace Gascon, C. 1992. Predators and Tadpole Prey in Central Amazonia: Field Data and Experimental
Manipulations. Ecology 73:971-980.Enlace Gascon, C. 1992. The Effects of Reproductive Phenology on Larval Performance Traits in a Three-Species Assemblage of Central Amazonian Tadpoles. Oikos 65:307-313.Enlace Neckel-Oliveira, S. y Wachlevski, M. 2004. Predation on the Arboreal Eggs of Three Species of Phyllomedusa in Central Amazonia. Journal of Herpetology 38:244-248. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Ron, S. R., Almendáriz, A., Cannatella, D. C. 2013. The Phyllomedusa perinesos group (Anura: Hylidae) is derived from a Miocene Amazonian Lineage. Zootaxa 3741:289-294. Duellman, W. E., Marion, A. B., Hedges, S. B. 2016. Phylogenetics, classification, and biogeography of the treefrogs (Amphibia: Anura: Arboranae). Zootaxa 4104:1. Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|
