|
Vernacular Name
Ranita reloj de arena
State/Provinces
Esmeraldas, Pichincha
Natural Regions
Bosque Piemontano Occidental, Bosque Húmedo Tropical del Chocó
Identification
Rana pequeña a mediana que se caracteriza por tener dorso marrón oscuro con una mancha triangular amarilla sobre el rostro que se extiende hacia los flancos a manera de franjas dorsolaterales que no llegan a la ingle; muslos con manchas amarillo o anaranjado uniforme, al igual que pelvis y talones; hocico corto, truncado; membrana axilar extensa (29). La especie más parecida dentro de su rango de distribución en Ecuador es Dendropsophus gryllatus de la que se diferencia por tener más membrana en la axila y entre los dedos de la mano (2). En Dendropsophus ebraccatus la membrana de los dedos de la mano se extiende hasta la mitad del largo de los dedos mientas que en Dendropsophus gryllatus solo alcanza 1/3. Con la excepción de Dendropsophus carnifex, las demás especies de Dendropsophus del Ecuador tienen rangos geográficos restringidos a la cuenca amazónica. Se diferencia de las especies del género Boana de la región Costa de Ecuador por su menor tamaño y por tener bandas laterales de color claro (ausentes en Boana; la presencia de membranas entre los dedos de los pies la diferencian fácilmente de las especies del género Pristimantis. Las ranas de cristal (familia Centrolenidae) difieren por su coloración predominantemente verde.
Description
Es una rana de tamaño pequeño a mediano con la siguiente combinación de caracteres (modificado de Duellman (24), Savage (22)): (1) cabeza ligeramente más ancha que larga, más ancha que el cuerpo, excepto en hembras grávidas; parte superior de la cabeza plana; (2) hocico corto, truncado en vista lateral y dorsal; narinas ligeramente protuberantes; canto rostral redondo, indistinto; región loreal apenas cóncava; labios moderadamente delgados, un poco hinchados; (3) ojos grandes; tímpano visible; pliegue cutáneo fino desde la esquina posterior del ojo hasta un punto sobre la inserción del brazo, oscurece el borde superior del tímpano; tímpano se separa del ojo por una distancia igual al diámetro del tímpano; (4) brazo moderadamente corto y robusto; membrana axilar extensa; borde externo del antebrazo sin pliegue cutáneo; pliegue transverso indistinto en la muñeca; (5) dedos manuales cortos, amplios; discos grandes; diámetro del disco del Dedo III levemente más grande que el diámetro del tímpano; (6) tubérculos subarticulares moderadamente largos, redondos, subcónicos; tubérculo distal del Dedo manual IV bífido; tubérculos supernumerarios largos, redondos, ubicados en una sola fila en el segmento proximal de cada dedo; tubérculo palmar grande, plano, bifurcado; (7) hendiduras vocales pares; un solo saco vocal subgular externo plenamente distensible en machos adultos; prepólex moderadamente alargado; almohadillas nupciales ausentes; (8) dedos manuales con membrana extensa; fórmula de la membrana: I 2-3 II 1+-2+ III 2+-2- IV; (9) dedos pediales largos, delgados; discos más pequeños que aquellos en los dedos manuales; fórmula de la membrana: I 1-2- II ½-1 III 1-2 IV 2+-1 V; (10) superficies dorsales lisas; vientre granular.
Color in Life
Dorso color amarillento bronce o amarillo con marcas color marrón oscuro y muslos uniformemente amarillos. Las marcas dorsales son altamente variables, consistiendo generalmente de una marca en forma de reloj de arena que se extiende desde los párpados hasta la región sacra. De noche las marcas dorsales son apenas discernibles, de día la coloración dorsal es más contrastante. El iris es bronce rojizo y puede o no tener manchas rojas. En machos en reproducción el saco vocal es amarillo brillante (24).
Males Face Cloacal Length Average
promedio = 25.9 mm (rango 23.1–29.3; n=100) (24
Females Face Cloacal Length Average
(rango 30.0-35.0 mm) (24
Habitat and Biology
Especie nocturna y arborícola que habita en bosque húmedo tropical primario y secundario y también en zonas donde la mayor parte del bosque ha sido destruida. La época reproductiva es prolongada y coincide con la época de mayor lluvia (24). Los machos suelen cantar sobre hojas de vegetación cercana a pozas temporales a menos de 2 m sobre el agua, o en borde de bosque, entre las 18:00 y 24:00 horas (22, 29). Su canto es un prolongado "wreek" como de insecto, seguido a veces por 1 a 4 "click". Los machos defienden su territorio con cantos o contacto físico, los encuentros generalmente incluyen cantos agresivos a pocos centímetros de distancia (22). Se ha reportado parasitismo sexual (6). Los huevos se depositan en el haz de hojas generalmente herbáceas que crecen sobre pozas, cada puesta puede contener 40 huevos; los renacuajos se desarrollan en el agua (24, 29). Touchon y Warkentin (14), encontraron que puede también depositar los huevos directamente en el agua, especialmente en los sitios sin sombra en donde los huevos se podrían deshidratar rápidamente fuera del agua.
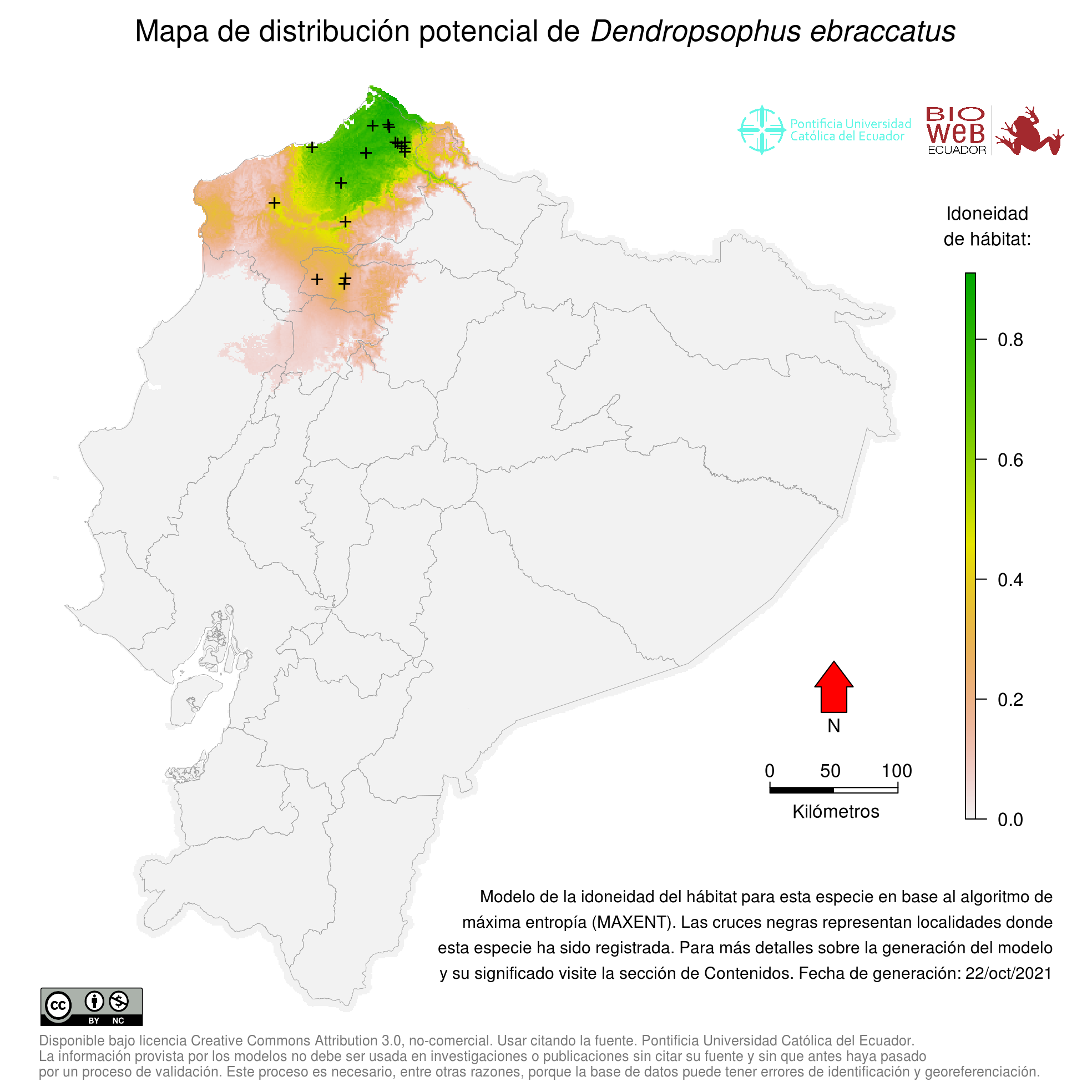
Distribution
Se distribuye en elevaciones bajas de la cuenca atlántica desde "Veracruz" meridional y el norte de "Oaxaca" hasta "Belice"; en las cuencas atlánticas y pacíficas desde Nicaragua hasta Costa Rica y Colombia. Hay una población aparentemente aislada en "Quintana Roo", México central (30). McCraine (10) resumió la distribución por departamentos en Honduras. En Ecuador se distribuye en las zonas más húmedas del noroccidente (32).
Altitudinal Range
Se encuentra de 0 a 1600 m sobre el nivel del mar (33).
Taxonomy and Evolutionary Relationships
Ubicada dentro del grupo de especies Dendropsophus leucophyllatus, es la especie hermana de un clado conformado por D. bifurcus, D. sarayacuensis, D. arndti, D. leucophyllatus, D. reticulatus y D. triangulum ( 1, 3, 31). Existen revisiones en Savage y Heyer ( 5), Duellman ( 24), Lee ( 8), Campbell ( 7) y Lee ( 9). Sin embargo los datos presentados por Wiens et al. ( 1) no apoyan la monofilia del grupo Dendropsophus leucophyllatus según lo definido por Faivovich et al. ( 3). Robertson et al. ( 25) detectaron (con mtDNA) cinco clados regionales en Dendropsophus ebraccatus. Estos clados son profundamente divergentes, recíprocamente monofiléticos en Centroamérica, y no existe mezcla entre linajes. Estos resultados se comparan con la variación fenotípica entre las poblaciones y su biogeografía. Ohmer et al. ( 26) reportaron la variación geográfica de tamaño del cuerpo, patrón de coloración y canto de anuncio, características que estaban en desacuerdo con el patrón filogenético. Ver también Sunyer et al. ( 23), Moen et al. ( 28). Ver sinonimia en Frost ( 30). En la filogenia de Jetz y Pyron ( 34) Dendropsophus ebraccatus está cercanamente relacionada a Dendropsophus sarayacuensis.
Etymology
El epíteto específico proviene del latín bracatus que significa “usando pantalones” y del prefijo "e-", que significa “sin pantalones” y se refiere literalmente a la condición sin pigmentación de los muslos (24).
Additional Information
Duellman ( 24) presenta datos de morfología, ocurrencia, historia natural, del renacuajo y vocalización en América Central. Sonogramas del canto son presentados por Duellman ( 24) y Wells y Greer ( 13). Wilczynski et al. ( 18) presentan información sobre la adaptación auditiva de la morfología de la laringe y del oído. En McClelland et al. ( 16) se describe la neurofisiología de la vocalización. Ressel ( 19) describen la fisiología y ultraestructura del músculo. Hay una considerable literatura en los aspectos de comportamiento y fisiología de vocalización en: Fouquette ( 17), Wells y Greer ( 13), Rand y Dudley ( 15), Wollerman ( 20), Duellman ( 6), Savage ( 22), Schwartz y Wells ( 21) y Reichart ( 27). Savage ( 22) y Lynch ( 11) describen el renacuajo. Touchon y Warkentin ( 12) encontraron que los renacuajos pueden cambiar su coloración y morfología en respuesta a depredadores específicos.



Summary Author
Morley Read, Santiago R. Ron y Gabriela Pazmiño-Armijos
Editor
Santiago R. Ron
Edition Date
2011-11-04T00:00:00
Update Date
2022-12-21T15:31:42.65
Literature Cited
Wiens, J. J., Kuczynski, C. A., Hua, X. y Moen, D. S. 2010. An expanded phylogeny of treefrogs (Hylidae) based on nuclear and mitochondrial sequence data. Molecular Phylogenetics and Evolution 55:871-882.PDF Duellman, W. E. 1973. Descriptions of new hylid frogs from Colombia and Ecuador. Herpetologica 29:219-227.PDF Faivovich, J., Haddad, C. F., García, P. C., Frost, D. R., Campbell, J. A. y Wheeler, W. C. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Museum of Natural History 294:1-240.PDF Cope, E. D. 1874. Description of some species of reptiles obtained by Dr. John F. Bransford, Assistant Surgeon United States Navy, while attached to the Nicaraguan surveying expedition in 1873. Proceedings of the Academy of Natural Science of Philadelphia, 26:121.PDF Savage, J. M. y Heyer, W. R. 1969. The tree frog (family Hylidae) of Costa Rica: diagnosis and distribution. Revista de Biología Tropical 16:1-27. Duellman, W. E. 2001. Hylid Frogs of Middle America. Society for the Study of Amphibians and Reptiles, Ithaca, New York. Campbell, J. A. 1998. Amphibians and reptiles of Northern Guatemala, Yucatan and Belize. University of Oklahoma Press, 400 pp. Lee, J. C. 1996. The amphibians and reptiles of the Yucatán Peninsula. Comstock Publ. Assoc., Ithaca, New York. Lee, J. C. 2000. A field guide to the amphibians and reptiles of the Maya world. Cornell University Press. Ithaca, New York, USA. McCraine, J. R. 2007. Distribution of the amphibians of Honduras by departments. Herpetological Review 38:35-39. Lynch, J. D. 2006. The tadpoles of frogs and toads found in the Lowlands of Northern Colombia. Acad. Colomb. Cienc. 30:443-457. Touchon, J. C. y Warkentin, K. M. 2008. Reproductive mode plasticity: Aquatic and terrestrial oviposition in a treefrog. PNAS 105:7495-7499 . Wells, K. D. y Greer, B. J. 1981. Vocal Responses to Conspecific Calls in a Neotropical Hylid Frog, Hyla ebraccata. Copea 1981 Annual Report:615-624 . Touchon, J. C. y Warkentin, K. M. 2008. Fish and dragonfly nymph predators induce opposite shifts in color and morphology of tadpoles. Oikos 117:634-640. Rand, A. S. y Dudley, R. 1993. Frogs in Helium: The Anuran Vocal Sac Is Not a Cavity Resonator. Physiological Zoology 66:793-806. McClelland, B., Wilczynski, W. y Rand, A. S. 1997. Sexual dimorphism and species differences in the neurophysiology and morphology of the acoustic communication system of two neotropical hylids. Journal of Comparative Physiology A 80:1432-1351 . Fouquette, Jr., M. J. 1960. Isolating Mechanisms in Three Sympatric Treefrogs in the Canal Zone. Evolution 40:484-497.PDF Wilczynski, W., McClelland, B. y Rand, A. S. 1993. Acoustic, auditory, and morphological divergence in three species of neotropical frog. Journal of Comparative Physiology A 172:1432-1351 . Ressel, S. J. 1996. Ultrastructural Properties of Muscles Used for Call Production in Neotropical Frogs. Physiological Zoology 69:952-973. Wollerman, L. 1998. Stabilizing and directional preferences of female Hyla ebraccata for calls differing in static properties. Animal Behavior 55:1619-1630. Schwartz, J. J. y Wells, K. D. 2006. Behavioral ecology of anuran communication. In: Springer (ed.) hearing and sound communication in amphibians.. Springer Handbook of Auditory Research 28:44-86. Savage, J. M. 2002. The amphibians and reptiles of Costa Rica: A herpetofauna between two continents, between two seas. University of Chicago Press, Chicago, USA, 934 pp. Sunyer, J., Páiz, G., Dehling, D. M. y Köhler, G. 2009. A collection of amphibians from Río San Juan, southeastern Nicaragua. Herpetology Notes 2:189-202. Duellman, W. E. 1970. Hylid Frogs of Middle America. Monograph Museum Natural History University of Kansas 1: 1-753.Enlace Robertson, J. M., Duryea, C. y Zamudio, K. R. 2009. Discordant patterns of evolutionary differentiation in two Neotropical treefrogs. Molecular Ecology 18:1375-1395. Ohmer, M. E., Robertson, J. M. y Zamudio, K. R. 2009. Discordance in body size, colour pattern, and advertisement call across genetically distinct populations in a Neotropical anuran (Dendropsophus ebraccatus). Biological Journal of the Linnean Society. London 19:298-313. Reichart, M. S. 2010. Aggressive thresholds in Dendropsophus ebraccatus: habituation and sensitization to different call types. Behavioral Ecology and Sociobiology 64:529-539.PDF Moen, D. S., Smith, S. A. y Wiens, J. J. 2009. Community assembly through evolutionary diversification and dispersal in Middle American treefrogs. Evolution 63:3228-3247.PDF MECN. 2010. Serie Herpetofauna del Ecuador: El Choco Esmeraldeño. Monografía. Museo Ecuatoriano de Ciencias Naturales. Quito-Ecuador 5:1-232. Frost, D. R. 2016. Amphibian Species of the World: an Online Reference. Version 6.0 (Date of access). Electronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.html. American Museum of Natural History, New York, USA. Caminer, M., Milá, B., Jansen, M., Fouquet, A., Venegas, P. J., Chávez, G., Lougheed, S. C., Ron, S. R. 2017. Systematics of the Dendropsophus leucophyllatus species complex (Anura: Hylidae): Cryptic diversity and the description of two new species. PLoS ONE 12(3): e0171785. doi:10.1371/journal.pone.0171785 Ron, S. R. 2018. Base de datos de la colección de anfibios del Museo de Zoología (QCAZ). Versión 1.0. Pontificia Universidad Católica del Ecuador. Disponible en https://bioweb.bio/portal/ Jungfer, K., Lynch, J., Morales, M., Solís, F., Ibañez, R., Santos-Barrera, G., Chaves, G., Bolaños, F., Sunyer, J. 2010. Dendropsophus ebraccatus. The IUCN Red List of Threatened Species 2010: e.T55470A11316147. http://dx.doi.org/10.2305/IUCN.UK.2010-2.RLTS.T55470A11316147.en. Downloaded on 27 August 2018. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858. Orrico, V. G. D., Grant, T., Faivovich, J., Rivera-Correa, M., Rada, M. A., Lyra, M. L., Cassini, C. S., Valdujo, P. H., Schargel, W. E., Machado, D. J., Wheeler, W. C., Barrio -Amorós, C., Loebmann, D., Moravec, J., Zina, J., Solé, M., Sturaro, M. J, Peloso, P. L. V, Suarez, P. y Haddad, C. F. B. 2020. The phylogeny of Dendropsophini (Anura: Hylidae: Hylinae) Cladistics, 37: 73-105.
|
