|
Vernacular Name
Rana terrestre del Napo
State/Provinces
Napo, Orellana, Pastaza, Sucumbíos, Morona Santiago
Natural Regions
Bosque Piemontano Oriental, Bosque Húmedo Tropical Amazónico
Identification
Es una rana pequeña de color café grisáceo, antebrazos anaranjados y vientre cremoso. Tiene el hocico largo y puntiagudo, los dedos I y II de la mano de igual tamaño, sin rebordes cutáneos en los dedos y discos expandidos ausentes. Estas características la diferencian de individuos pequeños de Leptodactylus discodactylus, Leptodactylus leptodactyloides, Leptodactylus petersii y Leptodactylus wagneri que tienen el Dedo I más grande que el Dedo II en la mano, presencia de rebordes cutáneos en los dedos de pies y vientre o garganta con moteado obscuro. El resto de Leptodactylus en la región que no tienen rebordes cutáneos en los dedos de pies, son más grandes (LRC > 29 mm) y tienen pliegues dorsolaterales conspicuos. No obstante, líneas dorsolaterales formadas por tubérculos glandulares son conspicuas en Adenomera hylaedactyla. Adenomera hylaedactyla se asemeja más a Adenomera andreae, pero se diferencia por poseer un hocico equivalente a una vez y media el diámetro del ojo (una vez el diámetro del ojo en Adenomera andreae), líneas dorsolaterales glandulares conspicuas (poco visibles en Adenomera andreae), pecho, superficie ventral de brazos y vientre claros (pecho y superficie ventral de brazos más obscura que el vientre en Adenomera andreae), y superficie posterior de vientre y superficie anterior de muslos amarillentas (grisáceas en Adenomera andreae) (18). Usando un análisis de función discriminante, Heyer (12) indica también que Adenomera hylaedactyla y Adenomera andreae son morfológicamente distintas. La ausencia de discos expandidos en los dígitos distingue a Adenomera hylaedactyla de Pristimantis, y la ausencia de membrana en los dedos de pies la distingue de Scinax y Rana (31, 32). Las poblaciones de Adenomera en Ecuador han sido adscritas a Adenomera hylaedactyla o Adenomera andreae; sin embargo, el estudio de Fouquet et al. (26) indica que ninguna de las dos especies se encontraría en el país (ver Taxonomía y relaciones evolutivas).
Description
Especie de tamaño pequeño con la siguiente combinación de caracteres (modificado de Rodríguez y Duellman (32); Angulo et al. (17); Lima et al (18)): (1) hocico moderadamente largo y puntiagudo; distancia entre ojo y punta de hocico es igual a una vez y media el diámetro del ojo; tímpano distinto; (2) dos líneas dorsolaterales formadas por tubérculos glandulares son bien definidas; (3) longitud de Dedo I = Dedo II en la mano; (4) dedos de pies carecen de membrana y rebordes cutáneos; (5) dígitos de manos y pies terminan en puntas apenas expandidas y redondeadas en vista dorsal y lateral.
Color in Life
Dorso varía de gris apagado a varias tonalidades de café con algunas marcas más obscuras, con o sin una línea dorsolateral crema a rosa; una línea media-dorsal crema puede estar presente en la parte posterior del cuerpo; marca interorbital triangular obscura con el ápice dirigido posteriormente; antebrazos anaranjados cremosos; vientre, pecho y región gular blancas cremosas; parte posterior de vientre y parte ventral de muslos amarillentas; iris bronce con manchas negras diminutas (17, 18, 32).
Males Face Cloacal Length Average
Promedio = 23.5 mm (rango 22.2–24.3; n = 5) (17
Females Face Cloacal Length Average
Promedio = 25.6 mm (rango 23.0–28.8; n = 5) (25
Habitat and Biology
Especie terrestre y principalmente nocturna, aunque también ha sido observada en el día; habita en la hojarasca y se la puede encontrar bajo troncos y rocas en áreas abiertas, bosque secundario, bancos de ríos y riachuelos, borde de bosque y claros agrícolas (5, 6, 18, 28, 29). Morley Read (notas de campo) reporta que la especie fue rara en el Parque Nacional Yasuní, Ecuador y únicamente fue registrada en bosque alterado en los bancos del Río Napo, donde fue común. Aunque presentan esencialmente la misma distribución geográfica, Adenomera hyaedactyla difiere ecológicamente de Adenomera andreae en que esta última es diurna y habita dentro de bosque (12, 29, 32). La reproducción ocurre a lo largo del año, pero con un pico en época lluviosa (6, 8, 18, 33). Los machos vocalizan desde hierbas, arbustos, abajo de hojarasca y troncos caídos en áreas abiertas; existe un canto de territorialidad y otro de advertencia, este último consiste en una nota aguda; el pico de actividad de vocalización es entre las 16:00–20:00 (14, 18, 32).
El macho escarba un agujero en el suelo donde la hembra es guiada para depositar un nido de espuma esférico o elíptico que contiene entre 7–25 (promedio = 13.6) huevos, de 2–3.4 mm de diámetro; los renacuajos son endotróficos y se desarrollan completamente dentro del nido en los agujeros terrestres (6, 8, 14, 18, 25, 28, 32). Kokobum y Giaretta (28) reportan que en una especie (Adenomera sp.) del Cerrado de Brasil, los renacuajos comienzan a generar espuma para el nido transcurridas 10 horas después de la oviposición, lo cual evita la compactación de los mismos y podría incrementar su eficiencia respiratoria y excretoria. Tales aspectos aún requieren ser investigados en Adenomera hylaedactyla. Adenomera hylaedactyla se alimenta principalmente de escarabajos, diplópodos y hormigas (18). Menin y Giaretta (27) mencionan que larvas de moscas (Beckeriella niger) infestan y depredan nidos de leptodactílidos sintópicos como Physaleamus y Leptodactylus, pero no de una especie de Adenomera, probablemente por el diferente grado de exposición al medio ambiente (nidos enterrados en Adenomera).
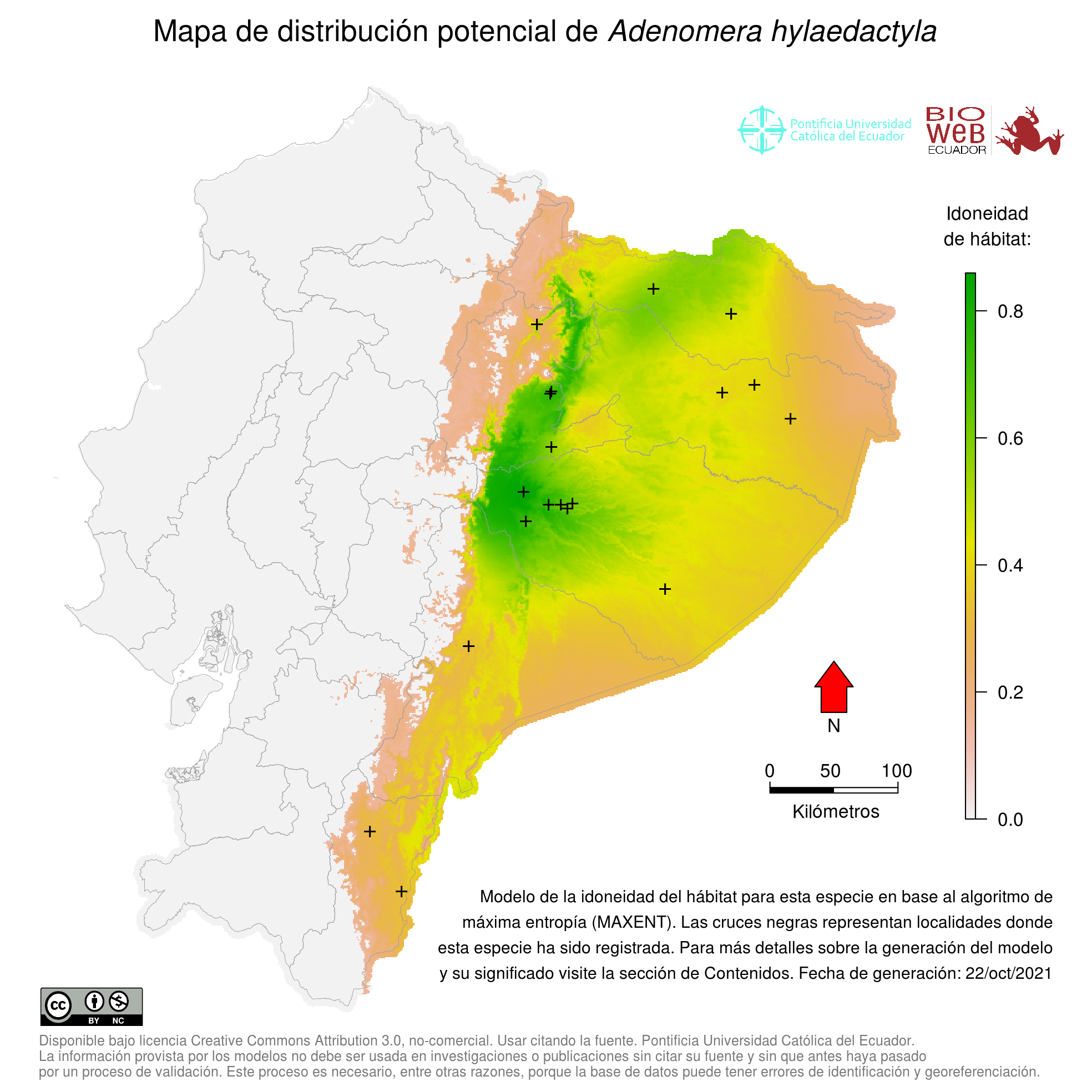
Distribution
Se distribuye en toda la Cuenca amazónica (excepto la Amazonía occidental), el Escudo guyanés, y hacia el sur en el bioma del Diagonal Seco (Chaco, Cerrado y Caatinga) y el extremo norte del Bosque atlántico (21, 26). Fouquet et al. (26) reporta que Adenomera hylaedactyla no se encontraría en Ecuador (ver Taxonomía y relaciones evolutivas).
Altitudinal Range
De 0 a 1000 m sobre el nivel del mar (19, 21).
Taxonomy and Evolutionary Relationships
Frost (21) provee sinónimos y comentarios taxonómicos. Heyer (4) la ubicó en el grupo de especies Leptodactylus marmoratus, pero posteriormente (10) resucitó el género Adenomera para los miembros de este grupo. Adenomera es un grupo taxonómicamente complejo y los especimenes preservados son de difícil identificación debido a la gran variación morfológica con-interespecífica, varias especies viven en simpatría e incluso sintopía, y existe una gran proporción de especies crípticas que todavía esperan descripción (17, 26). Ciertos autores han presentado evidencia morfológica (4), molecular (21, 22) y reproductiva (28) mostrando a Leptodactylus parafilético con respecto a Adenomera, y consecuentemente han sugerido sinonimizar Adenomera bajo Leptodactylus. Sin embargo, otras líneas de evidencia soportan la distinción de Adenomera como un género diferente de Leptodactylus, y que Lithodytes lineatus es su taxón hermano; a su vez ambos géneros formarían el clado hermano de Leptodactylus. Estas relaciones son soportadas por cariotipos (9), miología y osteología (15), cantos (17), ecología (23), y morfología y filogenética (3, 16, 20, 26, 29). Heyer (23), Kokobum y Giaretta (28), y de Sá et al. (16) reportan que Adenomera comparte características reproductivas con el grupo Leptodactylus fuscus lo que ha llevado a pensar una aparente relación; sin embargo, estas afinidades han evolucionado independientemente y así estos grupos no se encuentran cercanamente relacionados.Fouquet et al. (26) realizaron la revisión más reciente del género Adenomera en base a información molecular. Su estudio reveló que Adenomera se originó en la Amazonía, con subsecuentes dispersiones durante el Mioceno hacia el Diagonal Seco (Chaco, Cerrado y Caatinga) y al Bosque atlántico, las cuales estuvieron asociadas con cambios del bosque hacia hábitats abiertos. Su estudio indica que Adenomera hylaedactyla y Adenomera andreae no se encontrarían en Ecuador, y que el taxón presente en Ecuador es Adenomera simonstuarti, una especie descrita del Cuzco amazónico, Perú y que se encuentra muy relacionada con la nominal Adenomera andreae. Fouquet et al. (26) reconoce que Adenomera simonstuarti estaría conformada por varios subclados con alto soporte (incluyendo aquí muestras de Ecuador), lo que es también corroborado por diferencias en el canto de anuncio de especímenes de Ecuador vs. especímenes de la localidad tipo de Adenomera simonstuarti, revelando así la existencia de más de una especie (3 especies candidatas no confirmadas para Ecuador). Sin embargo, en ausencia de más evidencia, Fouquet et al. (26) conservativamente ubican a estos subclados bajo Adenomera simonstuarti. Anfibios del Ecuador reconoce que Adenomera hyledactyla y Adenomera andreae probablemente no se encuentren en el país, pero no comparte la decisión de Fouquet et al. (26) en designar a todas las especies de Ecuador bajo Adenomera simonstuarti. Por lo tanto, hasta que un estudio integrativo del género con un enfoque en especímenes de Ecuador pueda ser alcanzado, previsoramente se reconoce a Adenomera hylaedactyla y Adenomera andreae como especies presentes en el país. Por otro lado, en la filogenia de Jetz y Pyron (34) proponen a Adenomera hylaedactyla como especie hermana de Adenomera diptyx.
Additional Information
Pearman (7) y Vigle (2) se refieren a la especie que habita en Jatún Sacha (Provincia de Napo, Ecuador) como Adenomera andreae; sin embargo, la especie de Jatún Sacha es nocturna y se encuentra en bosque secundario, por lo que probablemente corresponda en realidad a Adenomera hylaedactyla. Heyer y Silverstone (30) describen el renacuajo y proveen una ilustración en vista lateral y del disco oral del mismo. Heyer y Peters (5) la incluyen en su clave de identificación para individuos adultos de Leptodactylus en Ecuador. Heyer (4) describe el renacuajo y presenta una ilustración en vista lateral y del disco oral; presenta también audioespetrogramas del canto de anuncio. Straughan y Heyer (24) y Angulo et al. (17) describen el canto acompañado de un oscilograma y audioespectrograma. Bogart (11) describen el cariotipo como 2N = 26 (1 par de cromosomas métacentricos, 2 submetacéntricos, 1 subtelocéntrico y 9 telocéntricos). Lima et al. (18) presentan fotografías de un macho y una hembra en vista dorsolateral, un macho en vista ventral, un macho vocalizando y renacuajos en un nido de espuma. Menin et al. (14) describen el ranacuajo con ilustraciones en vista lateral, dorsal y del disco oral; presenta también la descripción de dos tipos de canto (anuncio y territorial), acompañados de oscilogramas y audioespectrogramas. Ponssa y Heyer (13) describen el esqueleto óseo en Adenomera, y sugieren que los dos especímenes analizados de Ecuador (ambos identificados como Adenomera andreae) corresponderían a dos especies distintas. Sin embargo, en ausencia de más líneas de evidencia, no pudieron asignar ninguna de estas especies a Adenomera hylaedactyla o Adenomera andreae.



Summary Author
Diego A. Ortiz, Morley Read y Santiago R. Ron
Editor
Santiago R. Ron
Edition Date
2014-02-14T00:00:00
Update Date
2022-09-26T18:28:01.25
Literature Cited
Cope, E. D. 1868. An examination of the reptilia and batrachia obtained by the Orton expedition to Equador and the upper Amazon, with notes on other species. Proceedings of the Academy of Natural Sciences of Philadelphia 20:96-140. Vigle, G. O. 2008. The amphibians and reptiles of the Estación Biológica Jatun Sacha in the lowland rainforest of Amazonian Ecuador: a 20-year record. Breviora 514:1-27. Frost, D. R., Grant, T., Faivovich, J., Bain, R., Günther, A. C., Haas, A., Haddad, C. F., de Sá, R., Donnellan, S. C., Raxworthy, C. J., Wilkinson, M., Channing, A., Campbell, J. A., Blotto, B. L., Moler, P., Drewes, R. C., Nussbaum, R. A., Lynch, J. D., Green, D. y Wheeler, W. C. 2006. The amphibian tree of life. Bulletin of the American Museum of Natural History 297:370.PDF Heyer, W. R. 1973. Systematics of the Marmoratus group of the frog genus Leptodactylus (Amphibia, Leptodactyluidae). Natural History Museum of Los Angeles County Contributions in Science :1-50. Heyer, W. R. y Peters, J. A. 1971. The frog Genus Leptodactylus in Ecuador. Proceedings of the Biological Society of Washington 84:163-170. Toft, C. A. y Duellman, W. E. 1979. Anurans of the lower Río Llullapichis, Amazonian Peru: a preliminary analysis of community structure. Herpetologica 35:71-77.PDF Pearman, P. B. 1997. Correlates of amphibian diversity in an altered landscape of Amazonian Ecuador. Conservation biology 11:1211-1225. Aichinger, M. 1987. Annual activity patterns of anurans in a seasonal neotropical environment. Oecologia 71:583-592.PDF Heyer, W. R. y Diment, M. J. 1974. The karyotype of Vanzolinius discodactylus and comments on usefulness of karyotypes in determining relationships in the Leptodactylus-complex (Amphibia, Leptodactylidae). Proceedings of the Biological Society of Washington 87:327-336. Heyer, W. R. 1974. Relationships of the marmoratus species group (Amphibia, Leptodactylidae) within the subfamily Leptodactylinae. Contributions in Science. Natural History Museum of Los Angeles County 253:1-46.PDF Bogart, J. P. 1974. A Karyosystematic Study of Frogs in the genus Leptodactylus (Anura: Leptodactylidae). Copeia 1974:728-737.PDF Heyer, W. R. 1977. A discriminant function analysis of the frogs of the genus Adenomera (Amphibia:Leptodactylidae). Proceedings of the Biological Society of Washington 89:581-592. Ponssa, M. L. y Heyer, W. R. 2007. Osteological characterization of four putative species of the genus Adenomera (Anura: Leptodactylidae), with comments on intra- and interspecific variation. Zootaxa 1403:37-54.PDF Menin, M., De Almeida, A. P., Kokobum, M. N. C. 2009. Reproductive aspects of Leptodactytus hylaedactylus (Anura: Leptodactylidae), a member of the Leptodactylus marmoratus species group, with a description of tadpoles and calls. Journal of Natural History 43:2257-2270. Heyer, W. R. 1975. A preliminary analysis of the intergeneric relationships of the frog family Leptodactylidae. Smithsonian Contributions to Zoology 199:1-55. De Sá, R. O., Heyer, W. R., Camargo, A. 2005. A Phylogenetic Analysis of Vanzolinius Heyer, 1974 (Amphibia, Anura, Leptodactylidae): Taxonomic and life history implications. Arquivos do Museu Nacional, Río de Janeiro 63:707-726.PDF Angulo, A., Cocroft, R. B. y Reichle, S. 2003. Species identity in the genus Adenomera (Anura: Leptodactylidae) in southeastern Peru. Herpetologica 59:490-504.PDF Lima, A. P., Magnusson, W. E., Menin, M., Erdtmann, L., Rodrigues, D. J., Keller, C., Hödl, W. 2006. Guia de sapos da Reserva Adolpho Ducke, Amazônia Central = Guide to the frogs to Reserva Adolpho Ducke, Central Amazonia. Átemma, Manaus. 168 p. IUCN. 2010. The IUCN red list of threatened species. http://www.iucnredlist.org/apps/redlist/search. (Consultado: 2010). Pyron, R. A. y Wiens, J. J. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61:543-583. Frost, D. R. 2013. Amphibian Species of the World: an online reference. Version 5.6 (15 October, 2012). Base de datos accesible en http://research.amnh.org/vz/herpetology/amphibia/ American Museum of Natural History, New York, USA. Jansen, M., Bloch, R., Schulze, A., Pfenninger, M. 2011. Integrative inventory of Bolivia’s lowland anurans reveals hidden diversity. Zoologica Scripta 40:567-583. Heyer, W. R. 1969. The adaptative ecology of the species groups of the genus Leptodactylus (Amphibia, Leptodactylidae). Evolution 23:421-428.PDF Straughan, I. R. y Heyer, W. R. 1976. A functional analysis of the mating calls of the Neotropical frog genera of the Leptodactylus complex (Amphibia, Leptodactylidae). Papéis Avulsos de Zoologia 29:221-245. Aichinger, M. 1992. Fecundity and breeding sites of an anuran community in a seasonal tropical environment. Studies on Neotropical Fauna and Environment 27:9-18. Fouquet, A., Santana Cassini, C., Haddad, C. F. B., Pech, N., Rodrigues, M. T. 2013. Species delimitation, patterns of diversification and historical biogeography of the Neotropical frog genus Adenomera (Anura, Leptodactylidae). Journal of Biogeography. doi: 10.1111/jbi.12250 Menin, M. y Giaretta, A. A. 2003. Predation on foam nests of leptodactyline frogs (Anura: Leptodactylidae) by larvae of Beckeriella niger(Diptera: Ephydridae). Journal of Zoology 261:239-243. Kokobum, M. N. C. y Giaretta, A. A. 2005. Reproductive ecology and behaviour of a species of Adenomera (Anura, Leptodactylinae) with endotrophic tadpoles: Systematic implications. Journal of Natural History 39:1745-1758. Heyer, W. R. y Maxson, L. R. 1982. Distributions, relationships, and zoogeography of lowland frogs: The Leptodactylus complex in South America, with special reference to Amazonia. En Prance, T. P. (Ed.). 1982. Biological Diversification in the tropics. Columbia University Press: 375-388.PDF Heyer, W. R. y Silverstone, P. A. 1969. The larva of the frog Leptodactylus hylaedactylus (Leptodactylidae). Field Museum of Natural History 51:141-145. Duellman, W.E.1978. Three new species of Eleutherodactylus from Amazonian Perú (Amphibia: Anura: Leptodactylidae). Herpetologica 34:264-270. Rodríguez, L. O. y Duellman, W. E. 1994. Guide to the frogs of the Iquitos Region, Amazonian Perú. Asociación de Ecología y Conservación, Amazon Center for Environmental Education and Research and Natural History Museum, The University of Kansas. Lawrence, Kansas 22:1-80.PDF Duellman, W. E. 1995. Temporal Fluctuations in Abundances of Anuran Amphibians in a Seasonal Amazonian Rainforest. Journal of Herpetology 29:13-21. Jetz, W., Pyron, R. A. 2018. The interplay of past diversification and evolutionary isolation with present imperilment across the amphibian tree of life. Nature Ecology & Evolution 2: 850-858.
|
